PM2.5是连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤.机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
(1)将PM2.5样本用蒸馏水处理制成待测试样。测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
| 浓度/mol•L-1 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据判断PM2.5试样的pH 。
(2)汽车尾气的排放是城市重要的污染源,尾气含有的NO会破坏臭氧层。利用催化技术可将尾气中的NO和CO转变成CO2和N2,其反应方程式为:2NO+2CO=CO2+N2.为探究某种催化剂对反应速率的影响,t℃时,用气体传感器测得不同时间的NO和CO浓度如表:

请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
①在上述条件下反应能够自发进行,则反应的△H___________0(填写“>”、“<”、“=”)。
②前2s内的平均反应速率v(N2)=______________。
③在该温度下,反应的平衡常数K=________________。
④假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是________。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(3)某化学兴趣小组构想将NO转化为HNO3,装置如下图,电极为多孔惰性材料。则负极的电极反应式是 。

我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。
I.已知:2CO(g)+ O2(g)=2CO2(g),ΔH=-566 kJ·mol-1
2Fe(s)+  O2(g)=Fe2O3(s),ΔH=-825.5 kJ·mol-1
O2(g)=Fe2O3(s),ΔH=-825.5 kJ·mol-1
则CO还原Fe2O3反应的热化学方程式为: 。
Ⅱ.反应  Fe2O3(s)+ CO(g)
Fe2O3(s)+ CO(g)
 Fe(s)+ CO2(g)在1000℃的平衡常数等于4。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡。
Fe(s)+ CO2(g)在1000℃的平衡常数等于4。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡。
(1)反应到10min时,用CO2表示该反应的速率为 ,CO的平衡转化率=____________,平衡后再分别加入Fe、Fe2O3、CO、CO2各0.4mol,则正反应速率 逆反应速率(填“大于”、“小于”或“等于”)。
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是________.
a.降低反应温度
b.增大反应体系的压强
c.选取合适的催化剂
d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅲ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:
CO(g)+2H2(g) CH3OH(g),请根据图示回答下列问题:
CH3OH(g),请根据图示回答下列问题:

(1)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
| 容器 |
反应物投入的量 |
反应物的 转化率 |
CH3OH的浓度 |
能量变化 (Q1、Q2、Q3均大于0) |
| 甲 |
1molCO和2molH2 |
α1 |
c1 |
放出Q1kJ热量 |
| 乙 |
1molCH3OH |
α2 |
c2 |
吸收Q2kJ热量 |
| 丙 |
2molCO和4molH2 |
α3 |
c3 |
放出Q3kJ热量 |
则下列关系正确的是________.
A.c1=c2
B.2Q1=Q3
C.2a1=a3
D.a1+a2=1
E.该反应若生成1molCH3OH,则放出(Q1+Q2)kJ热量
(2)若在一体积可变的密闭容器中充入lmolCO、2molH2和1molCH3OH,达到平衡吋测得混合气体的密度是同温同压下起始的1.6倍,则该反应向________(填“正”、“逆”)反应方向移动。
(3)甲醇可与氧气构成燃料电池,该电池用多孔的惰性电极浸入浓氢氧化钾溶液,写出该电池的负极反应式______________________,若电解质溶液为酸性,写出正极反应式_________________。
SCR是一种烟气脱硝技术(除去烟气中的NOx),其流程如下:

(1)反应2NO+2CO 2CO2+N2的平衡常数表达式为 。
2CO2+N2的平衡常数表达式为 。
(2)SCR流程中发生的主要反应有:
4NO(g)+4NH3(g)+O2(g) 4N2(g)+6H2O(g) ΔH=-1627.2kJ•mol-1;
4N2(g)+6H2O(g) ΔH=-1627.2kJ•mol-1;
6NO(g)+4NH3(g) 5N2(g)+6H2O(g) ΔH=-1807.0 kJ•mol-1;
5N2(g)+6H2O(g) ΔH=-1807.0 kJ•mol-1;
6NO2(g)+8NH3(g) 7N2(g)+12H2O(g) ΔH=-2659.9 kJ•mol-1;
7N2(g)+12H2O(g) ΔH=-2659.9 kJ•mol-1;
反应N2(g)+O2(g) 2NO(g)的ΔH= kJ•mol-1。
2NO(g)的ΔH= kJ•mol-1。
(3)NO和NH3在Ag2O催化剂表面的反应活性随温度的变化曲线见下图。

①由图可以看出,脱硝工艺流程应在 (填“有氧”或“无氧”)条件下进行。
②随着反应温度的进一步升高,在有氧的条件下NO的转化率明显下降的可能原因是 。
(4)NO也可用尿素[CO(NH2)2]还原,写出尿素与NO反应的化学方程式: 。
(5)NO2、O2和熔融NaNO3可制作燃料电池,其原理见图:

写出石墨Ⅱ发生的电极反应为 。若生成1molN2O5,则理论上需要消耗标准状况下O2的体积为 L。
(1)氨气是一种重要的化工原料,合成氨的原料气之一H2可通过反应:
CH4(g)+H2O(g) CO2(g)+3H2(g) △H=+161.1KJ/mol获取。已知温度、压强对甲烷平衡含量的影响如图1,请回答:
CO2(g)+3H2(g) △H=+161.1KJ/mol获取。已知温度、压强对甲烷平衡含量的影响如图1,请回答:

①图-1中a、b、c、d四条曲线中的两条代表压强分别为1Mpa、2Mpa时甲烷含量曲线,其中表示1Mpa的是________。
②已知:在700 ℃,1 MPa时,1 mol CH4与1 mol H2O在1 L的密闭容器中反应,6min达到平衡(如图2),该温度下反应的平衡常数为______________(结果保留小数点后一位数字)。
③从图2分析,由第一次平衡到第二次平衡,平衡移动的方向是_________(填“向正反应方向”或“向逆反应方向”),采取的措施可能是_____________________。
(2)工业上用NH3和CO2反应可合成尿素:
2NH3(g)+ CO2(g) CO(NH2)2(g)+ H2O(g)△H1=—536.1 kJ/mol。
CO(NH2)2(g)+ H2O(g)△H1=—536.1 kJ/mol。
①其他条件不变,下列方法能同时提高化学反应速率和尿素产率的是 。
| A.通入氦气 | B.缩小体积 |
| C.加入催化剂 | D.除去体系中的水蒸气 |
②尿素可用于处理汽车尾气。CO(NH2)2(g)与尾气中NO反应生成CO2、N2、H2O(g)排出。
又知:4NH3(g)+ 6NO(g)= 5N2(g) + 6H2O(g) △H2=-1806.4 kJ/mol,
写出CO(NH2)2(g)与NO反应的热化学方程式 。
(3)美国Simons等科学家发明了使NH3直接用于燃料电池的方法,其装置用铂作为电极、加入碱性电解质溶液,其电池反应为 4NH3+3O2=2N2+6H2O。
①写出该燃料电池的正极反应式 。
②若用该燃料电池产生的电能在铁皮上镀锌(制白铁皮),某铁皮上现需要镀上9.75g锌,理论上至少需要消耗标准状况的氨气 L。
甲醇又称“木醇”,是无色有酒精气味易挥发的有毒液体。甲醇是重要的化学工业基础原料和液体燃料,可用于制造甲醛和农药,并常用作有机物的萃取剂和酒精的变性剂等。
(1)工业上可利用CO2和H2生产甲醇,方程式如下:
CO2(g)+3H2(g) CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
又查资料得知:①CH3OH(l)+1/2 O2(g) CO2(g)+2H2(g) △H=Q2kJ·mol-1
CO2(g)+2H2(g) △H=Q2kJ·mol-1
②H2O(g)=H2O(l) △H= Q3kJ·mol-1,则表示甲醇的燃烧热的热化学方程式为 。
(2)工业上可用CO和H2O (g) 来合成CO2和H2,再利用⑴中反应原理合成甲醇。某温度下,将1molCO和1.5molH2O充入10L固定密闭容器中进行化学反应:CO(g)+H2O(g) CO2(g)+H2(g) △H>0,当反应进行到10min时达到平衡,此时测得H2为0.6 mol。回答下列问题:
CO2(g)+H2(g) △H>0,当反应进行到10min时达到平衡,此时测得H2为0.6 mol。回答下列问题:
①0~10min内H2O(g)的平均反应速率为 。
②若想加快正反应速率的同时提高CO的转化率,可以采用的方法是 。
a.升高温度 b.缩小容器的体积
c.增大H2O (g)的浓度 d.加入适当的催化剂
③若保持温度容积不变再向其中充入1molCO和0.5molH2O(g),重新达到化学平衡状态时,此时平衡混合气体中H2的体积分数为 。
(3)甲醇燃料电池是符合绿色化学理念的新型燃料电池,下图是以甲醇燃料电池(甲池)为电源的电解装置。已知:A、B、C、D、E、F都是惰性电极,丙中为0.1 mol/L CuSO4溶液 (假设反应前后溶液体积不变) ,当向甲池通入气体a和b时,D极附近呈红色。回答下列问题:
①a物质是 ,A电极的电极反应式为 。
②乙装置中的总化学反应方程式为 。
③当乙装置中C电极收集到224mL(标况下)气体时, 丙中溶液的pH= 。
C、O、Na、Al、S、Cl是常见的六种元素。
(1)C元素位于元素周期表第 周期,第 族;C元素的一种中子数为8同位素的符号为 。
(2)用“大于”“小于”或“等于”填空
| 离子半径 |
酸性 |
还原性 |
得电子能力 |
| N3- Al3+ |
H2SO4 HClO4 |
O2- S2- |
35Cl 37Cl |
(3)①CaCO3和适量HCl溶液反应时,每产生4.4 g 气体(不考虑气体溶解),放热a kJ,则该反应的热化学方程式为 。
②上述反应至无气泡逸出后,取适量残留溶液,插入pH传感器并逐滴滴入碳酸钠溶液,测得pH变化曲线如图所示。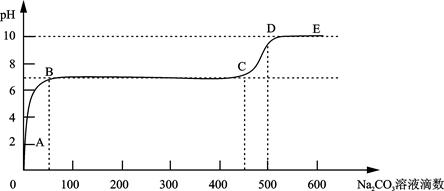
请用离子方程式表示B-C段发生的反应: 。
(4)氢气、氧气常用来作燃料电池,写出电解质为氢氧化钠溶液时负极上的电极方程式 。
(15分)常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源
(1)填充物用60 ℃温水溶解,目的是 。
(2)操作A的名称为 。
(3)铜帽溶解时加入H2O2的目的是 (用化学方程式表示)。
铜帽溶解完全后,可采用_____________方法除去溶液中过量的H2O2。
(4)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为 。
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。主要反应为 2MnO(OH)+MnO2+2H2C2O4+3H2SO4=2MnSO4+4CO2↑+6H2O。
①当1 mol MnO2参加反应时,共有 mol电子发生转移。
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出该反应的化学方程式: 。
(14分)CO、SO2是主要的大气污染气体,利用化学反应原理是治理污染的重要方法。
I、甲醇可以补充和部分替代石油燃料,缓解能源紧张。利用CO可以合成甲醇。
(2)一定条件下,在容积为VL的密闭容器中充入α mol CO与2a mol H2合成甲醇平衡转化率与温度、压强的关系如图所示。
①P1__P2(填“>”、“<”或“=”),理由是
②该甲醇合成反应在A点的平衡常数K= (用a和V表示)
③该反应达到平衡时,反应物转化率的关系是:CO H2(填“>” 、“<” 或“="”" )
④下列措施中能够同时满足增大反应速率和提高CO转化率的是 。(填写相应字母)
| A.使用高效催化剂 |
| B.降低反应温度 |
| C.增大体系压强 |
| D.不断将CH30H从反应混合物中分离出来 |
E、增加等物质的量的CO和H2
Ⅱ、某学习小组以SO2为原料,采用电化学方法制取硫酸。
(3)原电池法:该小组设计的原电池原理如图所示。写出该电池负极的电极反应式 。
(4)电解法:该小组用Na2SO3溶液充分吸收S02得到NaHSO3溶液,然后电解该溶液制得了硫酸。原理如下图所示。
写出开始电解时阳极的电极反应式 。
碳和氮的化合物与人类生产、生活密切相关。
(1)C、CO、CO2在实际生产中有如下应用:
a.2C + SiO2 Si + 2CO b.3CO + Fe2O3
Si + 2CO b.3CO + Fe2O3 2Fe + 3CO2
2Fe + 3CO2
c.C + H2O CO + H2 d.CO2 + CH4
CO + H2 d.CO2 + CH4 CH3COOH
CH3COOH
上述反应中,理论原子利用率最高的是 。
(2)有机物加氢反应中镍是常用的催化剂。但H2中一般含有微量CO会使催化剂镍中毒,在反应过程中消除CO的理想做法是投入少量SO2,为搞清该方法对催化剂的影响,查得资料:
则:① 不用通入O2氧化的方法除去CO的原因是 。
② SO2(g) + 2CO(g) =" S(s)" + 2CO2(g) △H = 。
(3)汽车尾气中含大量CO和氮氧化物(NO )等有毒气体。
)等有毒气体。
①活性炭处理NO的反应:C(s)+2NO(g) N2(g)+CO2 (g) ∆H=-a kJ·mol-1(a>0)
N2(g)+CO2 (g) ∆H=-a kJ·mol-1(a>0)
若使NO更加有效的转化为无毒尾气排放,以下措施理论上可行的是: 。

a.增加排气管长度 b.增大尾气排放口
c.添加合适的催化剂 d.升高排气管温度
②在排气管上添加三元催化转化装置,CO能与氮氧化物(NO )反应生成无毒尾气,其化学方程式是 。
)反应生成无毒尾气,其化学方程式是 。
(4)利用CO2与H2反应可合成二甲醚(CH3OCH3)。以KOH为电解质溶液,组成二甲醚 空气燃料电池,该电池工作时其负极反应式是 。
(5)电解CO制备CH4和W,工作原理如图所示,生成物W是 ,其原理用电解总离子方程式解释是 。
氢能是重要的新能源。储氢作为氢能利用的关键技术,是当前关注的热点之一。
(1)氢气作为能源最大的优点是燃烧产物是水,无污染。请你再列举一条氢气作为能源的优点:_____________________________________________。
(2)LiAlH4是一种重要的储氢载体,能与水反应得到LiAlO2和氢气,该反应消耗1mol LiAlH4时转移的电子数目为_______________________________________。
(3)氮化锂(Li3N)是非常有前途的储氢材料,其在氢气中加热时可得到氨基锂(LiNH2),其反应的化学方程式为;Li3N+2H2 LiNH2+2LiH,氧化产物为___________(填化学式)。在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的___________%(精确到0.1)。
LiNH2+2LiH,氧化产物为___________(填化学式)。在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的___________%(精确到0.1)。
(4)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢:
在某温度下,向恒容密闭容器中加入环己烷,其起始浓度为a mol·L-1,平衡时苯的浓度为b mol·L-1,该反应的平衡常数K=__________。
(5)一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物)。
①导线中电子移动方向为__________。(用A、D表示)
②生成目标产物的电极反应式为_______________________________。
③该储氢装置的电流效率η=_________________。
(η= ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)
(共14分)(1)美国麻省理工学院(MIT)近年来设计出镁锑液态金属电池,其工作原理如图所示,负极金属失去电子,并通过外电路做功,而负极金属离子化后通过熔盐迁移到正极并与正极金属合金化;充电则执行相反的过程。
写出电池放电时的正极反应式为 。
(2)我国锑的蕴藏量占世界第一位,辉锑矿(Sb2S3)是其主要矿物。某冶金课题组进行三氯化锑水溶液的电解研究,然后利用电解过程中阳极生成的五氯化锑作为浸出剂,对辉锑矿进行酸性浸出;从而实现浸出-电解的闭路循环,解决了传统炼锑过程中“工业三废”排放量大的问题。流程如图:
①写出锑元素在周期表中的位置 。
②“工业三废”指的是 。
③电解过程中阳极主要是Sb3+被氧化成Sb5+。请写出阴极的电极反应式 。
④根据流程图写出“浸出”步骤发生反应的化学方程式 。
⑤已知浸出液中除Sb3+外,还有Cu2+、Pb2+等重金属离子,其中c(Cu2+)=1.6×10-3mol·L-1,向浸出液中加入硫化钠至溶液中的Cu2+刚好完全沉淀,则c(S2-)= 。(已知Ksp(CuS)=8×10-45 Ksp(PbS)=3.4×10-28)
⑥还原除砷的原理是:在大于4mol·L-1的HCl溶液中,以次磷酸钠(Na3PO2)做还原剂,保持微沸温度,使AsCl3被还原为棕色单质砷沉淀,请配平该反应的化学方程式:
AsCl3 + Na3PO2 + HCl + H2O = As ↓+ H3PO3 + NaCl
(14分,每空2分))镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下: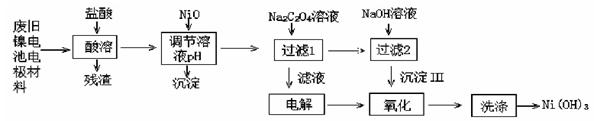
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②已知实验温度时的溶解度:NiC2O4> NiC2O4·H2O > NiC2O4·2H2O
③Ksp[Ni(OH)2]=5.0×10-16, Ksp(NiC2O4)=5.0×10-10;
回答下列问题:
(1)酸溶后所留残渣的主要成分为 (填物质名称)。
(2)用NiO调节溶液的pH,析出沉淀的成分为 (填化学式)。
(3)写出加入Na2C2O4溶液后反应的化学方程式: 。
(4)写出加入NaOH溶液所发生反应的离子方程式: 。
(5)电解过程中阴极反应式 ,沉淀Ⅲ可被电解所得产物之一氧化,写出氧化反应的离子方程式 。
(6)铁镍蓄电池,放电时总反应为:
Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是
| A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe |
| B.电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2 |
| C.电池充电过程中,阴极附近溶液的pH降低 |
| D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O |
某课外活动小组用如图装置进行实验,试回答下列问题。
(1)若开始时开关K与a连接,则B极的电极反应式为__________。
(2)若开始时开关K与b连接,则B极的电极反应式为____________,总反应的离子方程式为_________________________________。
(3)若开关K与b连接,下列说法正确的是(填序号)______________。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(4)如果模拟工业上离子交换膜法制烧碱的方法,将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为 。
某同学在用锌与稀硫酸反应制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气生成的速率。请回答下列问题:
(1)上述实验中,发生的化学反应方程式有______________________________
(2)硫酸铜溶液加快氢气生成的速率的原因______________________________
(3)实验室现有Na2SO4、MgSO4、HgSO4、K2SO4等四种溶液,可与上述实验中CuSO4溶液起相似作用的是____________________
(4)要加快上述实验中气体生成的速率,还可以采取的措施有____________
下图是一个化学过程的示意图。
(1)图中乙池是 装置。
(2)c(Pt)电极的名称是 。
(3)写出通入CH3OH的电极的电极反应式是 。
(4)乙池中反应的离子方程式为 。
(5)当乙池中B(Ag)极的质量增加5.40g时,甲池中理论上消耗O2 mL(标准状况下);此时丙池某电极析出1.6g某金属,则丙中的某盐溶液可能是 (填序号)
| A.MgSO4 | B.CuSO4 | C.NaCl | D.CuCl2 |