(1)海水中的钠盐、镁盐等都是重要的化工原料,从海水中提取铀、重水对一个国家来说具有战略意义。
①写出氯化镁的电子式__________________________
②重水的摩尔质量为____________________________
③写出金属镁的工业冶炼方程式__________________________________________
④海水淡化的常见方法有电渗析法、离子交换法、_________________
(2)比赛中,当运动员肌肉挫伤或扭伤时,随队医生即对准受伤部位喷射氯乙烷(沸点12.27℃)进行局部冷冻麻醉应急处理。
①乙烯和氯化氢在一定条件下反应的化学方程式是____________________________
②决定氯乙烷能用于冷冻麻醉应急处理的具体性质是________(填选项)
| A.沸点低 | B.沸点高 | C.易挥发 | D.难挥发 |
③甲烷与氯气光照下反应生成产物共________种
(3)“可燃冰”是天然气与水相互作用形成的晶体物质,若把“可燃冰”(用甲烷表示)燃烧在一定条件下改装成原电池,则在原电池的负极发生反应的物质是
水煤气不仅是合成氨的原料气也是合成烃及其化工产品的原料。
(1)直接水煤气燃料电池中,通CO、H2的极为电池的 极(选填:“正”,“负”)。
(2)水煤气变换反应:CO(g) + H2O(g)  CO2(g) + H2(g) △H < 0,下列措施能提高反应速率的有 (不定项选择)。
CO2(g) + H2(g) △H < 0,下列措施能提高反应速率的有 (不定项选择)。
a.升高温度 b.加入催化剂 c.增大压强 d.降低浓度
(3)H2和N2在催化剂、高温高压条件下合成氨的化学方程式为 。
(4)氨气的水溶液可用于吸收烟道气中的二氧化硫,该反应的化学方程式为 。
(5)将标准状况下582.4L合成气(已知:n(CO)∶n(H2)=4∶9)通入合成塔,一定条件下可发生2CO(g)+ 4H2(g) → CH2=CH2(g)+2H2O(g);CO(g)+3H2→CH4(g)+H2O(g),充分反应后,经测定产品中只有甲烷、乙烯和水蒸气(假定CO和H2均无剩余),试计算逸出的气体中乙烯的物质的量(列出计算过程)。
(8分)试用 ══
══ ↑的反应设计原电池。
↑的反应设计原电池。
(1)原电池中使用的电解质溶液是 ;
(2)写出电极反应式:
负极: ,
正极: ;
(3)在方框中画出此原电池的图,并标出电极材料的名称。
(11分)已知金属活动相差越大,形成原电池时越容易放电。请根据如图装置,回答下列问题: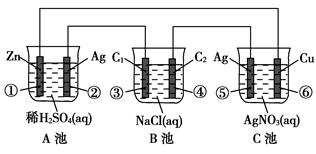
(1)各装置名称是:A池________,B池______,C池________。
(2)写出电极上发生的反应:①_____________,③___________,⑤_____________。
(3)当电路上有2 mol电子流过时,①极上质量变化______g,⑥极上质量变化______g。
(4)反应进行一段时间后,A、B、C三池中电解质溶液浓度不变的是________。
Ⅰ.将铂丝插入KOH溶液中做电极,并在两极片上分别通入甲烷和氧气,形成一种燃料电池,在该电池反应中,甲烷发生类似于燃烧的反应,根据以上判断:
(1)通甲烷的铂丝为原电池的_______极,发生的电极反应为_______________。
(2)该电池工作时(放电)反应的总化学方程式为___________________________________。
Ⅱ.铅蓄电池是化学电源,它工作时的电池反应为:PbO2+Pb+2H2SO4===2PbSO4+2H2O;
试回答:
(3)铅蓄电池正极的电极材料是_____________。
(4)工作时该铅蓄电池负极的电极反应是_____________________。
(5)铅蓄电池工作时,电解质溶液的密度_______(填“减小”“增大”或“不变”,下同),pH_______。
(6)如果用铅蓄电池做电源电解饱和食盐水制取Cl2,当制得0.05molCl2时,在理论上电池内部消耗的H2SO4的物质的量是______________。
分某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了一系列实验,实验结果记录如下:
请根据上表中的实验记录回答下列问题:
(1)实验1、2中的Al所作的电极是否相同?____________________。
(2)在实验3中,Al作__________极,电极反应式为___________,电池总反应式为__________。
(3)实验4中的Al作正极还是负极?____________________,原因是____________________。
(4)解释实验5中电流计指针偏向Al的原因:__________________。
(5)根据实验结果,总结在原电池中金属铝作正极还是负极受到哪些因素的影响?____________________。
能源问题是人类社会面临的重大课题,日本大地震引起的核泄漏事故引起了人们对核能源的恐慌。而甲醇是未来重要的绿色能源之一。
(1)已知:在25 ℃、101 kPa下,1 g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68 kJ。
请写出甲醇燃烧的热化学方程式 。
(2)目前有科学家在一定条件下利用水煤气(CO+H2)合成甲醇: 甲醇的物质的量与反应温度的关系如右图所示:
甲醇的物质的量与反应温度的关系如右图所示: 、
、
①合成甲醇反应的△H______0。(填“>”、“<”或“=”)
②其它条件不变,将E点的容积压缩到原来的1/2,正反应速率加快,逆反应速率____________。(填“加快”、“减慢”、“不变”),重新平衡时c(CH3OH)/c(CO)_________。(填“增大”、“减小”或“不变”)
③230℃时,平衡常数K=1。若其它条件不变,将温度升高到450℃时,达到平衡时,K 1(填“>、< 或 = ”)
(3)利用甲醇燃料电池设计如右图所示的装置:则该装置中Zn极为 极;写出a极的电极反应式
。
(1)分析如图所示的四个装置,回答下列问题:
①装置a和b中铝电极上的电极反应式分别为________________、________________。
②装置c中产生气泡的电极为________电极(填“铁”或“铜”),装置d中铜电极上的电极反应式为____________。
(2)观察如下图所示的两个装置,图1装置中铜电极上产生大量的无色气泡,图2装置中铜电极上无气体产生,而铬电极上产生大量的有色气体。根据上述现象试推测金属铬具有的两种重要化学性质为___________________、____ ____________。
某兴趣小组设计如下微型实验装置。实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表A指针偏转。
(1)断开K2,闭合K1时,直流电源 端为正极(填“A”或“B”),此时发生总反应的离子方程式为:
,电极附近溶液变红(填电极材料,下同);
(2)断开K1,闭合K2时,铜电极上的电极反应式为:
,
导线中电流从 电极到 电极,溶液中阴离子朝 电极方向移动。
(3)氯碱工业电解的饱和食盐水需要精制,为去除盐水中的Ca2+、Mg2+、Fe3+、SO42-,提供的试剂有①Na2CO3溶液 ②BaCl2溶液 ③NaOH溶液 ④HCl,则加入试剂的正确顺序是 。
现有A、B、C、D四种金属片,①把A、B用导线连接后同时浸入稀硫酸溶液中,A上有气泡产生;②把C、D用导线连接后同时浸入稀硫酸溶液中,D发生还原反应;③把A、C用导线连接后同时浸入稀硫酸溶液中,电子流动方向为A→导线→C.根据上述情况,回答下列问题:
(1)在①中,金属片 发生氧化反应;
(2)在②中,金属片 作负极;
(3)如果把B、D用导线连接后同时浸入稀硫酸溶液,则金属片 上有气泡产生;
(4)上述四种金属的活动性顺序是 .
将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图1的装置:(以下均假设反应过程中溶液体积不变)。
(1)铁片上的电极反应式为 。
(2)铜片周围溶液会出现 的现象。
(3)若2 min后测得铁片和铜片之间的质量差为1.2g,计算:
①导线中流过的电子的物质的量为 mo1;
②该段时间内用硫酸铜表示的平均反应速率为 mol·L-1·min-1
(4)若一段时间后测得铁片减少了2.4g,同时铜片增加了3.2g,计算这段时间内该装置消耗的化学能转化为电能的百分比为 。
(5)若将该装置改为如图2所示的装置也能达到和原装置相同的作用。其中KCl溶液起沟通两边溶液形成闭合回路的作用,同时又能阻止反应物直接接触。则硫酸铜溶液应该注入 (填“左侧”、“右侧”或“两侧”)烧杯中。
“嫦娥一号”的登月成功,实现了中国人“奔月”的梦想。
(1)2H2(g)+O2(g)=2H2O(l); H=-571.6kJ·mol-1
H=-571.6kJ·mol-1
C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1
C8H18(l)+12.5O2(g)=8CO2(g)+9H2O(l); H="-5518" kJ·mol-1
H="-5518" kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l)  H =-890kJ·mol-1
H =-890kJ·mol-1
相同质量的H2、C、 C8H18、CH4完全燃烧时,放出热量最多的是 。
(2) 氢气、氧气不仅燃烧能放出热量,二者形成的原电池还能提供电能。“嫦娥一号”绕月飞行部分使用的是氢氧燃料电池,电解质溶液为KOH溶液,其电极反应式为:
负极 ;正极 ;
(3)若用氢氧燃料电池电解100mL由NaCl 和CuSO4组成的混合溶液,其中[Na+]=3[Cu2+]=0.3mol·L-1,用石墨作电极,通电一段时间后,在阴极收集到0.112L H2(标况).
试计算:
①阴极析出Cu mol。阳极析出气体为 (填化学式)。
②若所得溶液仍然为100mL,则此时溶液的pH值为 。
按下图装置进行实验,并回答下列问题
(1)锌极为__________极,电极反应式为_________________________
石墨棒C1为______极,电极反应式为________________________
石墨棒C2附近发生的实验现象为_______________________________
(2)当C2极析出224mL气体(标准状态)时,锌的质量减少_________g.
X、Y、Z、W为按原子序数由小到大排列的四种短周期的元素。其中Y、W位于同一主族,Z、W位于同一周期;Y所组成的单质和氢化物中分别有一种具有漂白性;Z是同一周期中金属性最强的元素,X的某同位素原子的质子数与中子数相等且应用于核聚变反应。请回答下列问题:
(1)W的元素名称是_____。(2)X2Y2的电子式是_______。
(3)Z2WY3与X2WY4反应的离子方程式是____________ _
(4)如图所示的装置,烧杯中盛放的溶液为X2WY4,接通电流表G后,指针发生偏转,此时,负极材料是:__________正极反应式是_____ ___。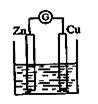
(5)若把铜片放入X2WY4溶液中,溶液无明显的变化,若在X2WY4溶液中加入X2Y2后,观察到铜片附近的溶液变蓝色,请写出反应的化学方程式:____________。