依据氧化还原反应2Ag+(aq)+Cu(s)===Cu2+(aq)+2Ag(s)设计的原电池如下图所示。请回答下列问题: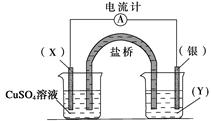
(1)电极X的材料是__________,电解质溶液Y是___________;
(2)银电极为电池的________极,发生的电极反应为___________; X电极上发生的电极反应为_________________________。
(3)外电路中的电子是从__________电极流向________电极。
依据氧化还原反应2Ag+(aq)+Cu(s)===Cu2+(aq)+2Ag(s)设计的原电池如下图所示。请回答下列问题:
(1)电极X的材料是__________,电解质溶液Y是___________;
(2)银电极为电池的________极,发生的电极反应为___________; X电极上发生的电极反应为_________________________。
(3)外电路中的电子是从__________电极流向________电极。