一种新型燃料电池,一极通入空气,另一极通入C4H10气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料电池说法正确的是
①在熔融电解质中,O2-由负极移向正极 ②电池的总反应是:2C4H10+13O2====8CO2+10H2O ③通入空气的一极是正极,电极反应为:O2+4e-====2O2-
④通入C4H10的一极是正极,电极反应为:C4H10+26e-+13O2-====4CO2+5H2O( )
| A.①② | B.②③ |
| C.①③ | D.②④ |
下列事实不用电化学理论解释的是( )
| A.轮船水线以下的船壳上装一定数量的锌块 |
| B.铝片不用特殊方法保护 |
| C.纯锌与稀硫酸反应时,滴入少量硫酸铜溶液后速率加快 |
| D.镀锌铁比镀锡铁耐用 |
根据下列实验事实
(1)X+Y2====X2+Y (2)Z+2H2O Z(OH)2+H2↑
Z(OH)2+H2↑
(3)Z2+的氧化性比X2+弱 (4)由Y、W电极组成的原电池,电极反应为W2++2e-="===W " Y-2e-====Y2+
可知X、Y、Z、W的还原性由强到弱的顺序是( )
| A.X>Z>Y>W |
| B.Z>W>X>Y |
| C.Z>X>Y>W |
| D.Z>Y>X>W |
关于如图所示装置的叙述,正确的是( )

| A.铜是阳极,铜片上有气泡产生 |
| B.铜片质量逐渐减少 |
| C.电流从锌片经导线流向铜片 |
| D.氢离子在铜片表面被还原 |
常用的纽扣式银锌电池,放电时的电极反应式分别为:
Zn极 Zn+2OH--2e-====Zn(OH)2
Ag2O极 Ag2O+H2O+2e-====2Ag+2OH-
则下列说法中不正确的是( )
| A.放电过程中c(OH-)不变 |
| B.Zn为负极而Ag2O为正极 |
| C.电解质溶液呈碱性 |
| D.电子从Ag2O流出经用电器后流入Zn极 |
锂电池是新一代的高能电池,它以质轻、能高而受到普遍重视。目前已经研制成功了多种锂电池。某种锂电池的总反应可表示为:Li+MnO2====LiMnO2,若该电池提供5 C电荷量(其他损耗忽略不计),则消耗的正极材料的质量约为(式量Li:7,MnO2:87,电子电荷量取1.60×10-19 C)( )
A.3.5×10-3 g B.7×10-4 g
C.4.52×10-3 g D.4.52×10-2 g
如图所示,电流计指针发生偏转,X极变粗,Y极变细,符合这种情况的组合是( )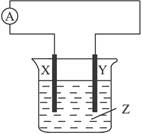
| A.X是Cu,Y是Zn,Z是稀H2SO4溶液 |
| B.X是Zn,Y是C,Z是CuSO4溶液 |
| C.X是Fe,Y是Cu,Z是Fe(NO3)3溶液 |
| D.X是Ag,Y是Zn,Z是AgNO3溶液 |
有关金属腐蚀的论述,正确的是().
| A.金属的腐蚀一定伴有电流产生 |
| B.Fe在干燥的氯气里比在潮湿的空气里更易被腐蚀 |
| C.发生化学能转变为电能的腐蚀时较活泼的金属总是作正极而被腐蚀 |
| D.发生电化腐蚀时都有能量的转变,且被腐蚀的金属总是失电子 |
下列事实不用原电池原理解释的是( )
| A.轮船水线以下的船壳上装一定数量的锌块 |
| B.铝片不用特殊方法保存 |
| C.纯锌与稀H2SO4反应时,滴入少量CuSO4溶液后速率加快 |
| D.白铁比马口铁耐腐蚀。 |
以锌片和铜片为两极,以稀硫酸为电解质溶液组成原电池,当导线中通过2mol电子时,下列说法正确的是( )
| A.锌片溶解了1mol时,铜片上析出1mol氢气 |
B.两极上溶解和析出的物质质量相等 |
C.锌片溶解了1g,铜片上析出1g氢气 |
D.锌片溶解了1mol,硫酸消耗了1mol |
一种新燃料电池,一极通入空气,另一极通入丁烷气体,电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体(在熔融状态下能传导O2-)。下列对该燃料电池说法正确的是( )
| A.在熔融电解质中,O2-由负极移向正极 |
B.电池的总反应是2C4H10+13O2 8CO2+10H2O 8CO2+10H2O |
C.通入空气的一极是负极,电极反应为O2+4e- 2O2- 2O2- |
D.通入丁烷的一极是正极,电极反应为C4H10+13O2- 4CO2+5H2O+26e- 4CO2+5H2O+26e- |
有a、b、c、d四种金属,将a与b用导线联结起来,浸入电解质溶液中,b不易腐蚀。将a、d分别投入等浓度盐酸中,d比a反应剧烈。将铜浸入b的盐溶液中,无明显变化。如果把铜浸入c的盐溶液中,有金属c析出。据此判断它们的活动性由强到弱的顺序是( )
| A.dcab | B.dabc | C.dbac | D.badc |
根据Zn+2H+ Zn2++H2↑的反应原理设计一个原电池,当Zn为负极时,正极可以选用的金属材料是( )
Zn2++H2↑的反应原理设计一个原电池,当Zn为负极时,正极可以选用的金属材料是( )
| A.镁 | B.石墨 | C.铝 | D.铅 |