某兴趣小组同学利用氧化还原反应:
2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,盐桥中装有饱和溶液.下列说法正确的是
| A.a电极上发生的反应为:MnO4-+8H++5e-═Mn2++4H2O |
| B.外电路电子的流向是从a到b |
| C.电池工作时,盐桥中的SO42-移向甲烧杯 |
| D.b电极上发生还原反应 |
某实验小组依据反应 设计如图1原电池,探究pH对AsO4 氧化性的影响。测得电压与pH的关系如图2。下列有关叙述不正确的是( )
设计如图1原电池,探究pH对AsO4 氧化性的影响。测得电压与pH的关系如图2。下列有关叙述不正确的是( )
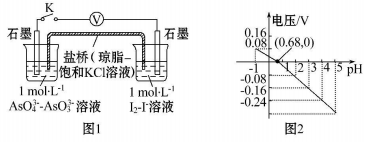
| A.调节pH可以改变反应的方向 |
| B.pH=0.68时,反应处于平衡状态 |
| C.pH=5时, 负极电极反应式为2I--2e -= I2 |
| D.pH>0.68时,氧化性I2>AsO43- |
下图所示的装置中,若通入直流电5 min时,铜电极质量增加2.16 g,试回答:
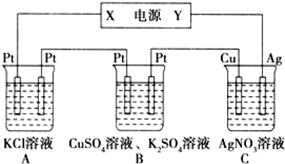
(1)电源电极X的名称为 。
(2)pH变化:A ,B ,C 。(填“增大”“减小”或“不变”)
(3)通电5 min后,B中共收集224 mL气体(标准状况),溶液体积为200 mL,则通电前CuSO4溶液的质的量浓度为 (设电解前后溶液体积无变化)。
(4)若A中KCl溶液的体积也是200 mL,电解后,溶液中OH-的物质的量浓度为 (设电解前后溶液体积无变化)。
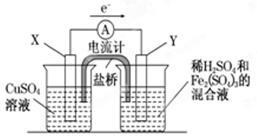
依据原电池原理,回答下列问题:
图(1) 图(2)
(1)图(1)是依据氧化还原反应:Cu(s)+2Fe3+(aq)=Cu2+(aq)+2Fe2+(aq)设计的原电池装置。
①电极X的材料为是 ;电极Y的材料为是 。
②Y电极发生的电极反应式为: 。
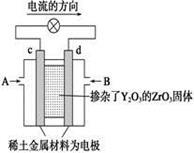
(2)图(2)是使用固体电解质的燃料电池,装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-离子(O2+4e―→2O2-)。
① c电极的名称为 ②d电极上的电极反应式为 。
下图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5 mol·L -1,工作一段时间后,测得有0.02 mol电子通过,若忽略溶液体积的变化,下列叙述正确的是
| A.产生气体体积 ①=② |
| B.①中阴极质量增加,②中正极质量减小 |
| C.电极反应式:①中阳极:4OH- - 4e- = 2H2O+O2 ↑ ②中负极:2H + +2e-=H2 ↑ |
| D.溶液的pH变化:①减小,②增大 |
某合作学习小组的同学利用下列氧化还原反应设计 原电池:2KMnO4 + 10FeSO4 + 8H2SO4=2MnSO4 + 5Fe2(SO4)3+K2SO4+8H2O,盐桥中装有饱和K2SO4溶液。下列叙述中正确的是
| A.乙烧杯中发生还原反应 |
| B.甲烧杯中溶液的pH逐渐减小 |
| C.电池工作时,盐桥中的SO42-移向甲烧杯 |
| D.外电路的电流方向是从a到b |
某电源装置如图所示,电池总反应式为:2Ag+Cl2===2AgCl。下列说法正确的是
| A.正极反应为AgCl+e-═Ag+Cl- |
| B.放电时,交换膜右侧溶液中有大量白色沉淀生成 |
| C.若用NaCl溶液代替盐酸,则电池总反应随之改变 |
| D.当电路中转移0.01mol e-时,交换膜左则溶液中约减少0.02mol离子 |
发生在天津港“8·12”特大火灾爆炸事故,再一次引发了人们对环境问题的关注。
(1)为了减少空气中SO2的排放,常采取的措施是将煤转化为清洁气体燃料。
已知:H2(g)+1/2O2(g)==H2O(g) ΔH1=-241.8 kJ·mol-1
C(s)+1/2O2(g)===CO(g) ΔH2=-110.5 kJ·mol-1
则焦炭与水蒸气反应生成CO的热化学方程式为: 。
(2)由于CaC2、金属钠、金属钾等物质能够跟水反应给灾后救援工作带来了很多困难。如果在实验室,你处理金属钠着火的方法是 。
(3)事故发生后,爆炸中心区、爆炸区居民楼周边以及海河等处都受到了严重的氰化物污染。处理NaCN的方法是:用NaClO在碱性条件下跟NaCN反应生成无毒害的物质,试写出该反应的离子反应方程式 。
(4)电化学降解法可用于治理水中硝酸盐的污染。电化学降解NO3-的原理如图所示,电源正极为 (填“a”或“b”);若总反应为4NO3-+4H+=5O2↑+2N2↑+2H2O,则阴极反应式为 。

(5)欲降低废水中重金属元素铬的毒性,可将Cr2O72-转化为Cr(OH)3沉淀除去。已知在常温下:Ksp[Fe(OH)2]= 1×10-15、Ksp[Fe(OH)3]= 1×10-38、Ksp[Cr(OH)3]= 1×10-23,当离子浓度在1×10-5mol/L以下时认为该离子已经完全沉淀,请回答:
①相同温度下Fe(OH)3的溶解度 Cr(OH)3的溶解度(填“>”、“<”或“=”)
②浓度为0.1mol/L的Fe2+与10. 0mol/L Cr3+同时生成沉淀的pH范围是 。
金属铁是应用广泛,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可利用离子交换和滴定的方法。实验中称取3.25g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用1.0 mol·L-1的盐酸中和滴定,正好中和时消耗盐酸60.0mL。计算该样品中氯的物质的量,并求出FeClx中x的值: (列出计算过程)。
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe)∶n(Cl) = 1∶2.8,则该样品中FeCl3的物质的量分数为 。
(3)把SO2气体通入FeCl3溶液中,发生反应的离子方程式为 。
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为 ;与MnO2—Zn电池类似,K2FeO4—Zn也可以组成碱性电池,其中Zn极的电极反应式为 ,K2FeO4的电极反应式为 。
锂离子电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性。锂离子电池放电时的电极反应式为:负极反应:C6Li-xe-==C6Li1-x+xLi+(C6Li表示锂原子嵌入石墨形成复合材料)
正极反应:Li1-xMO2+xLi++x e-==LiMO2(LiMO2表示含锂的过渡金属氧化物)
下列有关说法正确的是( )
| A.锂离子电池充电时电池反应为C6Li+Li1-xMO2==LiMO2+C6Li1-x |
| B.电池反应中,锂、锌、银、铅各失去1mol电子,金属锌所消耗的质量最小 |
| C.锂离子电池放电时电池内部Li+向负极移动 |
| D.锂离子电池充电时阴极反应为C6Li1-x+xLi++x e-==C6Li |
某小组用下图装置进行实验,下列说法正确的是( )
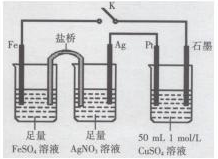
| A.盐桥中的电解质可以用KCl |
| B.闭合K,外电路电流方向为Fe电极→石墨电极 |
| C.闭合K,石墨电极上只生成铜 |
| D.导线中流过0.15 mol e﹣时,加入5.55gCu2(OH)2CO3,CuSO4溶液可恢复原组成 |
实验题
I.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的离子方程式有 ;
(2)实验室中现有Na2SO4、MgSO4、FeSO4、K2SO4等4种溶液,可与实验中CuSO4溶液起相似作用的是 ;
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实验 混合溶液 |
A |
B |
C |
D |
E |
F |
| 4mol/LH2SO4/mL |
30 |
V1 |
V2 |
V3 |
V4 |
V5 |
| 饱和CuSO4溶液/mL |
0 |
0.5 |
2.5 |
5 |
V6 |
20 |
| H2O/mL |
V7 |
V8 |
V9 |
V10 |
10 |
0 |
①完成此实验设计,其中:V1= ,V6= ,V9=
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因 。
Ⅱ、某兴趣组进行下列实验测定某稀硫酸的质量分数,选用酚酞做指示剂。
操作①:取5.00 mL稀H2SO4溶液(密度为1.00 g/mL)置于锥形瓶中加水稀释;
操作②:用0.1000 mol/LKOH标准溶液滴定;
操作③:用同样方法滴定,4次消耗KOH溶液的体积分别为20.00 mL、19.98 mL、20.02 mL、20.40 mL。
请回答下列问题:
(4)如何判定滴定终点:______________________________________________。
(5)在上述实验中,下列操作会造成测定结果偏高的有________(填序号)。
A.锥形瓶用待测液润洗
B.量取稀H2SO4溶液的滴定管用蒸馏水洗净,未用稀H2SO4溶液润洗
C.滴定速度过快,又未摇匀,停止滴定后发现红色褪去
D.滴定前读数时平视,滴定终点读数时仰视
(6)分析数据,计算稀H2SO4溶液中溶质的质量分数为_________ (保留三位有效数字)。
气体的自动化检测中常常应用原电池原理的传感器。下图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号。下表列出了待测气体及敏感电极上部分反应产物。则下列说法中正确的是
| 待测气体 |
部分电极反应产物 |
| NO2 |
NO |
| Cl2 |
HCl |
| CO |
CO2 |
| H2S |
H2SO4 |
A.上述气体检测时,敏感电极均作电池正极
B.检测分别含H2S和CO体积分数相同的两份空气样本时,传感器上产生的电流大小相同
C.检测H2S时,对电极充入空气,对电极上的电极反应式为O2 + 2H2O+ 4e- = 4OH-
D.检测Cl2时,敏感电极的电极反应式为:Cl2 + 2e-= 2Cl-
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )

| A.两烧杯中铜片表面均无气泡产生 |
| B.甲中铜片是正极,乙中铜片是负极 |
| C.两烧杯中溶液的pH均增大 |
| D.产生气泡的速度甲比乙慢 |
(1)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到。
第一步:2CH3OH(g)  HCOOCH3(g)+2H2(g) △H>O
HCOOCH3(g)+2H2(g) △H>O
第二步:HCOOCH3(g)  CH3OH(g)+CO(g) △H>O
CH3OH(g)+CO(g) △H>O
第一步反应的机理可以用图1表示,中间产物X的结构简式为___________。
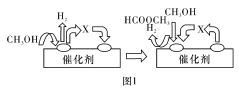
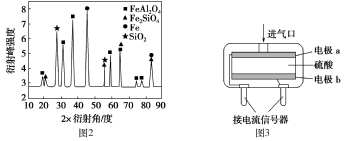
(2)为进行相关研究,用CO还原高铝铁矿石,反应后固体物质的X-射线衍射谱图如图2所示(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。反应后混合物中的一种产物能与盐酸反应生产两种盐,该反应的离子方程式为:_____________。
(3)某催化剂样品(含Ni2O340%,其余为SiO2)通过还原、提纯两步获得镍单质:首先用CO将33.2g样品在加热条件下还原为粗镍;然后在常温下使粗镍中的Ni与CO结合成Ni(CO)4、(沸点43℃),并在180℃时使Ni(CO)4重新分解产生镍单质。上述两步中消耗CO的物质的量之比为______________。
(4)为安全起见,工业生产中需对空气中的CO进行监测。使用电化学一氧化碳气体传感器定量检测空气中CO含量,其结构如图3 所示。这种传感器利用原电池原理,则该电池的负极反应式为:_____________________。