在BaSO4饱和溶液中加入少量的BaCl2溶液,产生BaSO4沉淀,若以Ksp表示BaSO4的溶度积常数,则平衡后溶液中
| A.c(Ba2+)=c(SO42-)=(Ksp)1/2 |
| B.c(Ba2+)·c(SO42-)>Ksp,c(Ba2+)=c(SO42-) |
| C.c(Ba2+)·c(SO42-)=Ksp,c(Ba2+)>c(SO42-) |
| D.c(Ba2+)·c(SO42-)≠Ksp,c(Ba2+)<c(SO42-) |
下列说法正确的是
| A.反应CaCO3(s)=CaO(s)+CO2(g),在常温下不能自发进行,则该反应的△H<0 |
B.0.lmol·L一1CH3COOH溶液加水稀释后,溶液中 的值减小 的值减小 |
| C.铅蓄电池在放电过程中,负极质量增加,正极质量减少 |
| D.锅炉中沉积的CaSO4和BaSO4都可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去 |
下列图示与对应的叙述相符的是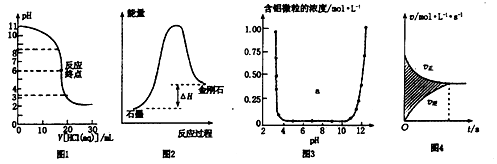
| A.图1表示0.001 mol·L一1盐酸滴定0.001 mol·L一1NaOH溶液的滴定曲线 |
| B.图2所示,石墨的熔点比金刚石低 |
| C.图3表示的是Al3+与OH一反应时含铝微粒浓度变化曲线,图中a区域的物质是Al(OH)3 |
| D.图4所示,图中的阴影部分面积的含义是「v(正)一v(逆)〕 |
已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。下列说法错误的是
| A.AgCl不溶于水,不能转化为AgI |
| B.在含有浓度均为0.001 mol·L-1的Cl-、I-的溶液中缓慢加入AgNO3稀溶液,首先析出AgI沉淀 |
| C.AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI |
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于 ×10-11mol·L-1 ×10-11mol·L-1 |
已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12。某溶液中含有Cl-、Br-和Cr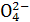 ,浓度均为0.010 mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
,浓度均为0.010 mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
A.Cl-、Br-、Cr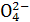 |
B.Cr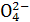 、Br-、Cl- 、Br-、Cl- |
C.Br-、Cl-、Cr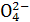 |
D.Br-、Cr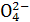 、Cl- 、Cl- |
以MnO2为原料制得的MnCl2溶液中常含有Cu2+、Pb2+、Cd2+等金属离子,通过添加过量难溶电解质MnS,可使这些金属离子形成硫化物沉淀,经过滤除去包括MnS在内的沉淀,再经蒸发、结晶,可得纯净的MnCl2。根据上述实验事实,可推知MnS具有的相关性质是( )。
| A.具有吸附性 | B.溶解度与CuS、PbS、CdS等相同 |
| C.溶解度大于CuS、PbS、CdS | D.溶解度小于CuS、PbS、CdS |
常温下,以MnO2为原料制得的MnCl2溶液中常含有Cu2+、Pb2+、Cd2+等,通过添加过量的难溶电解质MnS,可使这些金属离子形成硫化物沉淀并过滤除去,下列说法正确的是( )
| A.过滤后的溶液中一定没有S2﹣ |
| B.MnS难溶于水,可溶于MnCl2溶液中 |
| C.常温时,CuS、PbS、CdS比MnS更难溶 |
| D.加入MnS后生成CuS的离子方程式是Cu2++S2﹣=CuS↓ |
在25℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最终出现黑色沉淀。已知有关物质的溶度积KSP(25℃)如下:
| |
AgCl |
Agl |
Ag2S |
| KSP(单位省略) |
1.8×10-10 |
1.5×10-16 |
1.8×10-50 |
下列论述错误的是( )
A.沉淀转化的实质就是沉淀溶解平衡的移动
B.溶解度小的沉淀可以转化为溶解度更小的沉淀
C.AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解度相同
D.25℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不相同
已知25℃时,Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=5.0×10-13。该温度下,下列说法错误的是( )
| A.AgCl的悬浊液中通入少量HCl,c(Ag+)减小 |
| B.AgCl和AgBr共存的悬浊液中,c(Cl-)/c(Br-)=360 |
| C.AgBr悬浊液中加入足量NaCl可能有AgCl沉淀生成 |
| D.等浓度的NaCl和NaBr混合溶液中滴加AgNO3溶液,先析出AgCl沉淀 |
已知溶液中存在平衡:Ca(OH)2 (s)  Ca2+(aq)+2OH-(aq) ΔH<0。下列有关该平衡体系的叙述正确的是( )
Ca2+(aq)+2OH-(aq) ΔH<0。下列有关该平衡体系的叙述正确的是( )
| A.升高温度,固体的量减少 |
| B.加入少量Na2CO3粉末能增大钙离子的浓度 |
| C.降低温度,溶液中c(OH-)增大 |
| D.恒温下加入少量CaO,溶液的pH增大 |
室温时,M(OH)2(s)  M2+(aq)+2OH-(aq) Ksp=a,c(M2+)="b" mol·L-1时,溶液的pH等于
M2+(aq)+2OH-(aq) Ksp=a,c(M2+)="b" mol·L-1时,溶液的pH等于
A.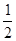 lg( lg(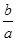 ) ) |
B.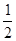 lg( lg(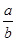 ) ) |
C.14 + 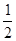 lg( lg(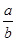 ) ) |
D.14 + 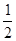 lg( lg(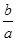 ) ) |
I.氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
(1)氨的水溶液显弱碱性,其原因为 (用离子方程式表示),0.1 mol·L-1的氨水中加入少量的NH4Cl固体,溶液的PH (填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度 (填“增大”或“减小”)。
(2)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为 ,平衡常数表达式为 ;
Ⅱ.25℃,在0.10mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-) 关系如右图(忽略溶液体积的变化、H2S的挥发)。

①pH=13时,溶液中的c(H2S)+c(HS-)= mol·L-1.
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH= 时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]
25℃时,用Na2S沉淀Cu2+、Zn2+两种金属离子(M2+),所需S2﹣最低浓度的对数值lgc(S2﹣)与lgc(M2+)的关系如图所示,下列说法不正确的是( )
| A.25℃时K(CuS)约为1×10﹣35 |
| B.向100mLZn2+、Cu2+浓度均为10﹣5mol•L﹣1的混合溶液 中逐滴加入10﹣4mol•L﹣1的Na2S溶液,Cu2+先沉淀 |
| C.Na2S溶液中:c(S2﹣)+c(HS﹣)+c(H2S)═2c(Na+) |
| D.向Cu2+浓度为10﹣5mol•L﹣1的工业废水中加入ZnS粉末,会有CuS沉淀析出 |
工业上向锅炉里注入Na2CO3溶液浸泡,将水垢中的CaSO4转化为CaCO3而后用盐酸去除。下列叙述不正确的是
| A.温度升高,Na2CO3溶液的Kw和c(OH一)均会增大 |
| B.沉淀转化的离子方程式为CO32-+CaSO4=CaCO3+SO42- |
| C.盐酸溶液中,CaCO3的溶解性大于CaSO4 |
| D.Na2CO3溶液遇CO2后,阴离子浓度均减小 |