(l)常温下,如果取0.1mol•L﹣1HA溶液与0.1mol•L﹣1NaOH溶液等体积混合,测得混合液的pH=8.混合液中由水电离出的OH﹣浓度与0.1mol•L﹣1NaOH溶液中由水电离出的OH﹣浓度之比为_________ .
(2)相同温度下,将足量硫酸钡固体分别放入相同体积的①0.1mol•L﹣1硫酸铝溶液 ②0.1mol•L﹣1氯化钡溶液 ③蒸馏水 ④0.1mol•L﹣1硫酸溶液中,Ba2+浓度由大到小的顺序是_________ .(用序号填写)
(3)常温下,将a mol•L﹣1的氨水与0.1mol•L﹣1的盐酸等体积混合,当溶液中c(NH4+)=c(Cl﹣)时,用含a的代数式表示NH3•H2O的电离常数Kb= _________ mol•L﹣1.
常温时,Ksp[Mg(OH)2] = 1.1×10-11,Ksp(AgCl) = 1.8×10-10,Ksp(Ag2CrO4) = 1.9×10-12 Ksp(CH3COOAg) = 2.3×10-3,下列叙述不正确的是
| A.浓度均为0.2mol·L-1AgNO3溶液和CH3COONa溶液等体积混合一定产生CH3COOAg沉淀 |
| B.将0.001mol·L-1的AgNO3溶液滴入0.001mol·L-1的KCl和0.001mol·L-1的K2CrO4的混合溶液中,先产生Ag2CrO4沉淀 |
| C.c(Mg2+)为0.11mol·L-1的溶液中要产生Mg(OH)2沉淀,溶液的pH要控制在9以上 |
| D.在其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变 |
下列由实验现象得出的结论正确的是:
| |
操作及现象 |
结论 |
| A |
向AgCl悬浊液中加入NaI溶液时出现黄色沉淀。 |
Ksp(AgCl)< Ksp(AgI) |
| B |
向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红色。 |
溶液中一定含有Fe2+ |
| C |
向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色。 |
Br—还原性强于Cl— |
| D |
加热盛有NH4Cl固体的试管,试管底部固体消失,试管口有晶体凝结。 |
NH4Cl固体可以升华 |
已知25℃时,电离常数Ka(HF)=3.6×10-4 mol·L-1,溶度积常数Ksp(CaF2)=1.46×10-10 mol·L-3。现向1L 0.2 mol·L-1 HF溶液中加入1L 0.2 mol·L-1 CaCl2溶液,则下列说法中正确的是( )
| A.25℃时,0.1 mol·L-1HF溶液中pH=1 | B.KSP(CaF2)随温度和浓度的变化而变化 |
| C.该体系中有CaF2沉淀产生 | D.以上说法均不正确 |
(1)已知t ℃时AgCl的Ksp=2×10-10;(2)在t ℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
| A.在t ℃时,Ag2CrO4的Ksp为1×10-9 |
| B.在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到X点 |
| C.在t ℃时,以0.01 mol/L AgNO3溶液滴定20 mL0.01 mol/L KCl和0.01 mol/L的K2CrO4的混和溶液,Cl-先沉淀 |
| D.在t ℃时,AgCl的溶解度大于Ag2CrO4 |
氮及其化合物在生产、生活中有着重要作用,减少氮氧化物的排放是环境保护的重要内容之一,请回答下列氮及其化合物的相关问题:
(1)N4的分子结构与白磷分子的正四面体结构相似。已知断裂1mol N-N键吸收167kJ热量,生成1mol N≡N键放出942kJ热量,请写出N4气体转变为N2反应的热化学方程式: 。
(2)NH3可直接用作车用燃料电池,产物无污染。写出碱性介质下该电池负极的电极反应式: 。
(3)在T1℃时,将5mol N2O5置于10L固定容积的密闭容器中发生下列反应:2N2O5(g)  4NO2(g)+O2(g);△H>0;反应至5分钟时各物质的浓度不再发生变化,测得NO2的体积分数为50%。
4NO2(g)+O2(g);△H>0;反应至5分钟时各物质的浓度不再发生变化,测得NO2的体积分数为50%。
①T1℃时该反应的平衡常数K的计算式为 。
②用O2表示从0~5min内该反应的平均速率υ(O2) = 。
③将上述平衡体系的温度降至T2℃,密闭容器内减小的物理量有 。
A.压强 B.密度 C.反应速率 D.N2O5的浓度
(4)在恒温恒容的密闭容器中充入NO2,建立如下平衡:2NO2(g)  N2O4(g),平衡时N2O4与NO2的物质的量之比为a,其它条件不变的情况下,分别再充入NO2和再充入N2O4,平衡后引起的变化正确的是 。
N2O4(g),平衡时N2O4与NO2的物质的量之比为a,其它条件不变的情况下,分别再充入NO2和再充入N2O4,平衡后引起的变化正确的是 。
A.都引起a减小
B.都引起a增大
C.充入NO2引起a减小,充入N2O4引起a增大
D.充入NO2引起a增大,充入N2O4引起a减小
(5)25℃时,NH3·H2O电离常数Kb=1.8×10-5,Mg(OH)2的溶度积常数Ksp=1.8×10-11,用pH计测得0.5 mol·L一1氨水溶液的pH约为 。在某氯化镁溶液中加入一定量某浓度的氨水后,测得混合液pH =11.0,则此温度下残留在溶液中的c(Mg2+)= 。(已知lg2≈0.3、lg3≈0.5)。
下列是25 ℃时某些盐的溶度积常数和弱酸的电离平衡常数,下列说法正确的是
| 化学式 |
AgCl |
Ag2CrO4 |
CH3COOH |
HClO |
H2CO3 |
| Ksp或Ka |
Ksp=1.8×10-10 |
Ksp=9.0×10-12 |
Ka=1.8×10-5 |
Ka=3.0×10-8 |
Ka1=4.1×10-7 Ka2=5.6×10-11 |
A.相同浓度CH3COONa和NaClO的混合溶液中,各种离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B.次氯酸钠溶液中通入少量CO2的离子方程式为:2ClO-+CO2+H2O=CO32-+2HClO
C.向0.1 mol·L-1 CH3COOH溶液中滴加NaOH溶液中至c(CH3COOH):c(CH3COO-)=5:9,此时溶液的pH=5
D.向浓度均为1.0×10-3 mol·L-1的KCl和K2CrO4混合溶液中滴加1.0×10-3 mol·L-1的AgNO3溶液,CrO42―先形成沉淀
分别依据下列实验事实,得出的结论正确的是
| |
实验事实 |
结论 |
| A |
将“84”消毒液(含NaClO)滴入品红溶液中,褪色缓慢,若同时加入食醋,红色很快褪为无色 |
随溶液pH减小,“84”消毒液的氧化能力增强 |
| B |
苯酚和水的浊液中,加碳酸钠溶液,溶液变澄清 |
苯酚的酸性比碳酸强 |
| C |
铜放入稀硫酸中,无明显现象,再加入硝酸钠固体,溶液变蓝,有明显的气泡放出,铜溶解 |
硝酸钠可以加快铜与稀硫酸的反应速率 |
| D |
向1mL 0.1mol/L的硝酸银溶液中加入1mL0.1mol/LNaCl溶液,出现白色沉淀,再加入几滴0.1mol/L NaBr溶液,有淡黄色沉淀生成 |
氯化银的溶解度小于溴化银 |
铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各 种性能的不锈钢,CrO3 大量地用于电镀工业中。
(1)在下图装置中,观察到图 1 装置铜电极上产生大量的无色气泡,而图 2 装置中铜电 极上无气体产生,铬电极上产生大量有色气体。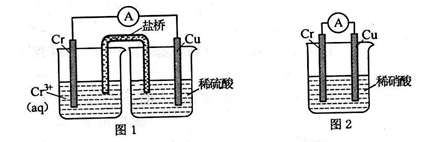
图 2 装置中铬电极的电极反应式______________________
(2)最近赣州酒驾检查特别严,利用 CrO3具有强氧化性,有机物(如酒精)遇到 CrO3时,猛烈反应,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3],另该过程中乙醇被氧化成乙酸, 从而增强导电性,根据电流大小可自动换算出酒精含量。写出该反应的化学方程式为_________________________
(3)虽然铬加到铁中可将铁做成不锈钢可减少金属腐蚀,但 生产成本高,生活中很多情况下还是直接使用钢铁,但易腐蚀, 利用右图装置,可以模拟铁的电化学防护。若 X 为碳棒,为 减缓铁的腐蚀,开关 K 应置于________处。若 X 为锌,开关K 置于________处。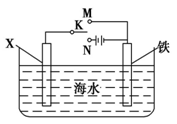
(4)CrO3 和 K2Cr2O7 均易溶于水,这是工业上造成铬污染的 主要原因。净化处理方法之一是将含+6 价 Cr 的废水放入电解槽内,用铁作阳极,加入 适量的 NaCl 进行电解:阳极区生成的 Fe2+和 Cr2O72-发生反应,生成的 Fe3+和 Cr3+在阴极 区与OH-结合生成 Fe(OH)3和 Cr(OH)3沉淀除去【已知某条件下的KspFe (OH)3 = 3.0×10-31, KspCr(OH)3 = 6.0×10-38】。已知电解后的溶液中 c(Fe3+)为 2.0×10-6 mol·L1,则溶液中c(Cr3+)为______________mol·L-1。
下列相关实验能达到预期目的的是( )
| |
相关实验 |
预期目的 |
| A |
相同温度下,将等质量的大理石块、大理石粉末分别加入等体积、等浓度的盐酸和醋酸中,观察气泡产生的快慢 |
验证固体接触面积对化学反应速率的影响 |
| B |
可逆反应FeCl3(aq)+3KSCN(aq) Fe(SCN)3(aq)+3KCl(aq)建立平衡后,在其它条件不变时,加入KCl固体,观察体系颜色的变化 Fe(SCN)3(aq)+3KCl(aq)建立平衡后,在其它条件不变时,加入KCl固体,观察体系颜色的变化 |
验证浓度对化学平衡的影响 |
| C |
室温下,向BaSO4悬浊液中加入饱和Na2CO3溶液,过滤后,再向沉淀中加入盐酸,沉淀部分溶解 |
验证BaSO4和BaCO3Ksp的相对大小 |
| D |
相同温度下,两支试管中装有等体积、等浓度的H2O2溶液,向其中分别加入少量FeCl3固体和少量的MnO2固体 |
验证不同催化剂对H2O2分解速率的影响 |
电解质水溶液中可存在电离平衡,水解平衡,溶解平衡,依据所学回答下列问题。
(1)等物质的量浓度的下列四种溶液:①NH3·H2O ②(NH4)2SO3③KHSO3④K2SO3溶液中水的电离程度由大到小的排列顺序为________________(填序号)。
(2)体积相同、c(H+)相同的三种酸溶液①CH3COOH;②HCl;③H2SO4分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是(填序号) _____________。将c(H+)相同的三种酸均加水稀释至原来的10倍,c(H+)由大到小的顺序为_____________(填序号)。
(3)已知,H+ (aq) + OH-(aq) ="=" H2O(l) ΔH =-57.3 kJ/mol。实验测得稀醋酸与稀NaOH溶液反应生成1 mol H2O时放出57 kJ的热,则醋酸溶液中,醋酸电离的热化学方程式为____________。
(4)25℃时,NH3·H2O的电离常数为Kb=1.7×10-3。0.1mol·L-1NH4Cl溶液的pH=a,则c(NH4+)∶c(NH3·H2O)=_________(用含a的代数式表示)
(5)某化学研究性学习小组对电解质溶液作如下归纳总结(均在常温下),其中正确的有( )
①pH=1的强酸溶液,加水稀释后,溶液中各离子浓度一定都降低
②pH=2的盐酸与pH=13的NaOH溶液,按体积比9:1混合后的溶液pH为11
③pH相等的三种溶液:a.CH3COONa;b.NaHCO3;c.NaOH.其溶液物质的量浓度由小到大顺序为c、b、a
④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(SO42﹣)
⑤亚磷酸(H3PO3)是二元弱酸,所以Na2HPO3稀溶液一定呈碱性
⑥甲、乙两溶液都是强电解质,已知甲溶液的pH是乙溶液pH的两倍,则甲、乙两溶液等体积混合,混合液pH可能等于7.
⑦某二元酸在水中的电离方程式是H2B═H++HB﹣;HB﹣ H++B2﹣,则0.1mol/L的Na2B溶液中,c(Na+)=2c(B2﹣)+2c(HB﹣)
H++B2﹣,则0.1mol/L的Na2B溶液中,c(Na+)=2c(B2﹣)+2c(HB﹣)
(6)25℃时Ksp[Mg(OH)2]=5.6×10-12,Ksp[Cu(OH)2]=2.2×10-20,
Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.1×10-33。在25℃下,向浓度均为0.1mol·L-1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式)。现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+刚好完全沉淀时,测定c(Al3+)=0.2mol·L-1。此时所得沉淀中________(填“还含有”或“不含有”)Al(OH)3。
I.下表是不同温度下水的离子积数据:
| 温度/℃ |
25 |
t 1 |
t 2 |
| 水的离子积 KW |
1×10-14 |
1×10-13 |
1×10-12 |
试回答以下问题:
(1)25℃下,某 Na2SO4溶液中 c(SO42-)=5×10-4 mol∙L-1,取该溶液 1mL 加水稀释至10mL,则稀释后溶液中 c(Na+):c(OH-)=____________。
(2)在 t 2℃下,将 a mol∙L-1CH3COOH 溶液与 b mol∙L-1NaOH 溶液等体积混合反应后,溶液恰好呈中性,则该温度下 CH3COOH 的电离常数 Ka=____________(用 a、b 表示)。
II.已知:25℃下,下列反应:①Ag+(aq)+2NH3(aq)  Ag(NH3)2+(aq) △H =" a" kJ∙mol-1 K = c
Ag(NH3)2+(aq) △H =" a" kJ∙mol-1 K = c
②2Ag+(aq)+2OH-(aq)  Ag2O(s)+H2O(l) △H =" b" kJ∙mol-1 K = d
Ag2O(s)+H2O(l) △H =" b" kJ∙mol-1 K = d
(3)写出 Ag2O溶于氨水(用 NH3表示)生成银氨溶液[Ag(NH3)2+]的热化学方程式:_____________;
计算 25℃下,该反应的平衡常数(用 c、d 表示)K =____________________。
III.某镁盐溶液中含有杂质离子Cr3+,所含主要离子及其浓度如下表所示(H+和OH-未列出):
| 离子 |
Mg2+ |
Cr3+ |
Cl- |
| 浓度(mol/L) |
0.5 |
0.01 |
a |
已知 25℃时,Ksp[Cr(OH)3]=10-32;Ksp[Mg (OH)2]=5×10-11;操作过程中溶液体积的变化忽略不计。
(4)表格中的 a____________1.03(填“<”、“>”或“=”)。
(5)除去杂质Cr3+离子,可加入MgO调节溶液 pH,理论上应调节 pH 的范围是_______________。
(6)溶液经除杂、过滤后,由滤液制取氯化镁晶体(MgCl2∙6H2O)的操作是___________________。
下列溶液或浊液中,关于离子浓度的说法正确的是( )
| A.一定浓度的氨水加水稀释的过程中,c(NH4+)/ c(NH3·H2O)的比值减小 |
| B.浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液中:c(CO32-)< c(HCO3-),且 3c(Na+)=2[c(CO32-)+c(HCO3-+ c(H2CO3)] |
| C.0.2 mol·L-1的醋酸(CH3COOH)溶液与0.1 mol·L-1 NaOH溶液等体积混合后: c(CH3COO-) + 2c(OH-)=c(CH3COOH) + 2c(H+) |
| D.常温下,已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2Cr2O4)=2.0×10-12, |
则Ag2CrO4悬浊液中的c(Ag+)一定小于AgCl悬浊液中的c(Ag+)
常温下,几种难溶电解质的溶度积和弱酸的电离常数如下表所示:
| |
CaSO4 |
CaCO3 |
MgCO3 |
Mg(OH)2 |
CuS |
BaSO4 |
H2S |
H2CO3[] |
| KSP或Ka |
9.1х10-6 |
2.8х10-9 |
6.8х10-6 |
1.8х10-11 |
6.3х10-36 |
1.1х10-10 |
Ka1=1.3х10-7 Ka2=7.1х10-15 |
Ka1=4.4х10-7 Ka2=4.7х10-11 |
则下列说法不正确的是
A.相同温度、相同浓度的钠盐溶液的pH:Na2S>Na2CO3>NaHS>NaCl>NaHSO4
B.在NaHS溶液中滴加硫酸铜溶液,生成黑色沉淀:HS-+Cu2+===CuS↓+H+
C.除去锅炉中的水垢时,通常先加入足量硫酸钠溶液,将碳酸钙转化成硫酸钙,然后再用酸液处理
D.在Mg(HCO3)2溶液中滴加澄清石灰水发生反应的离子方程式为Mg2++2HCO+2Ca2++4OH-===Mg(OH)2↓+2CaCO3↓+2H2O
工业上制备氯化铜时,是将浓盐酸用水蒸汽加热至80℃左右,慢慢加入粗制氧化铜粉(含杂质氧化亚铁),充分搅拌,使之溶解,反应如下:
CuO + 2HCl=CuCl2 + H2O ,FeO + 2HCl = FeCl2 + H2O。
已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;
pH≥4.4时,Cu2+以Cu(OH)2的形式开始沉淀; pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀。
(1)为除去溶液中Fe2+,可采用的方法是 。
(2)工业上为除去溶液中的_________。溶液的pH变化是 。
(3)若此溶液只含Fe3+时,要调整pH在3~4之间,此时最好向溶液中加入 。
(4)已知溶液中c(Cu2+)与溶液pH的关系为lg c(Cu2+)=8.6-2pH,若溶液中c(Cu2+)为1 mol/L,要保证此溶液中Cu2+刚好不发生Cu(OH)2沉淀,则溶液pH应为___________,此时溶液中的铁离子能否沉淀完全_________(填“能”或“否”)。