下表是三种难溶金属硫化物的溶度积常数(25℃):
| 化学式 |
FeS |
CuS |
MnS |
| 溶度积 |
6.3×10-18 |
1.3×10-36 |
2.5×10-13 |
下列有关说法中正确的是( )
A.25℃时,CuS的溶解度大于MnS的溶解度
B.25℃时,饱和CuS溶液中,Cu2+的浓度为1.3×10-36 mol•L-1
C.因为H2SO4是强酸,所以反应CuSO4+H2S=CuS↓+H2SO4不能发生
D.除去某溶液中的Cu2+,可以选用FeS作沉淀剂
已知:25 ℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=1×10-9。
Ba2+对人体有毒,医学上进行消化系统X射线透视时,常用BaSO4作内服造影剂。胃酸酸性很强(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是:
__________________________________________________________。
万一误服了少量BaCO3,应尽快用大量0.5 mol/L Na2SO4溶液给患者洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为__________mol/L。
下列说法正确的是
| A.室温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 |
| B.相同温度下,将足量氯化银固体分别加入:①蒸馏水、 ② 0.1 mol·L-1氯化镁溶液、③ 0.1 mol·L-1盐酸、④ 0.1 mol·L-1硝酸银溶液中,充分溶解后Ag+浓度:①> ③=④>② |
| C.室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后溶液的pH<7 |
| D.为确定某酸H2A是强酸还是弱酸,可测定室温时NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
在25℃时,有100g饱和Ca(OH)2溶液,向其中加入纯CaO粉末a g,反应后温度恢复到25℃,下列有关该溶液的说法正确的是
| A.溶液中c(Ca2+)将增大 | B.溶液的pH将增大 |
| C.溶液中Ca2+总数将减少 | D.溶液中c(OH-)减小 |
下列有关说法正确的是
| A.将AlCl3溶液蒸干得到的固体是AlCl3 |
| B.锅炉水垢中的CaSO4可用饱和Na2CO3溶液浸泡,再用稀盐酸溶解除去 |
| C.加热纯水,KW变大、pH变小、呈酸性 |
| D.在饱和BaSO4溶液中加入少量Na2SO4固体,溶液中c(Ba2+)增大 |
25 ℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=2.6×10-9。该温度下,下列说法不正确的是( )
| A.向同浓度的Na2SO4和Na2CO3的混合溶液中滴加BaCl2溶液,BaSO4先析出 |
| B.向BaCO3的悬浊液中加入少量的新制氯水,c(Ba2+)增大 |
C.BaSO4和BaCO3共存的悬浊液中, = = |
| D.向BaSO4的悬浊液中加入Na2CO3的浓溶液,BaSO4不可能转化为BaCO3 |
化学用语是学习化学的重要工具,下列化学用语中,正确的是( )
A.NH的水解反应离子方程式:NH+H2O NH3·H2O+H+ NH3·H2O+H+ |
| B.在AgCl悬浊液中加入KI溶液充分振荡:Ag++I-===AgI↓ |
| C.锌铜原电池,负极的电极反应式为: Cu2++2e-=== Cu |
| D.某反应ΔH<0,则该反应在任意条件下均可自发进行 |
在t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl的Ksp=4×10-10,下列说法不正确的是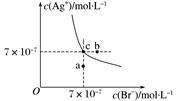
| A.在t ℃时,AgBr的Ksp为4.9×10-13 |
| B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点变到b点 |
| C.图中a点对应的是AgBr 的不饱和溶液 |
D.在t ℃时,AgCl(s)+Br-(aq)  AgBr(s)+Cl-(aq)的平衡常数K≈816 AgBr(s)+Cl-(aq)的平衡常数K≈816 |
硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如图,下列说法正确的是
| A.283 K时,图中a点对应的溶液是不饱和溶液 |
| B.三个不同温度下,363 K时Ksp(SrSO4)最大 |
| C.温度一定时,Ksp(SrSO4)随c(SO)的增大而减小 |
| D.283 K下的SrSO4饱和溶液升温到363 K后变 |
为不饱和溶液
已知25 ℃时,BaCO3的溶度积Ksp=2.58×10-9,BaSO4的溶度积Ksp=1.07×10-10,则下列说法不正确的是
| A.25 ℃时,当溶液中c(Ba2+)·c(SO42-)=1.07×10-10时,此溶液为BaSO4的饱和溶液 |
| B.25 ℃时,在含有BaCO3固体的饱和溶液中滴入少量Na2SO4溶液后有BaSO4沉淀析出,此时溶液中c(CO)∶c(SO)≈24.11 |
| C.因为Ksp(BaCO3)>Ksp(BaSO4),所以无法将BaSO4转化为BaCO3 |
| D.在饱和BaCO3溶液中加入少量Na2CO3固体,可使c(Ba2+)减小,BaCO3的溶度积不变 |
已知常温下:Ksp(AgCl)=1.8×10-10mol2·L-2,Ksp(Ag2CrO4)=1.9×10-12mol3·L-3。则下列叙述正确的是
| A.AgCl在饱和NaCl溶液中的KSP比在纯水中的KSP小 |
| B.向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明Ksp(AgCl)<Ksp(AgBr) |
| C.将0.001mol·AgNO3溶液滴入0.001mol·L-1KCl和0.001mol·L-1K2CrO4混合溶液中,产生Ag2CrO4 |
| D.向AgCl的悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动 |
已知Ksp (AgCl)=1.8×10-10,Ksp(AgI)=1.0 ×10-16。下列关于难溶物之间转化的说法中错误的是
| A.AgCl难溶于水,不能转化为AgI |
| B.同一类型难溶物的Ksp相差越大,难溶物就越容易转化为更难溶的物质 |
| C.常温条件下,将饱和的AgCl溶液和AgI溶液等体积混合,会有沉淀生成 |
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须大于(1/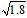 )×10-11mol/L )×10-11mol/L |
已知298K时,Mg(OH)2的溶度积常数KSP=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13.0,则下列说法不正确的是
| A.所得溶液中的c(H+)=10-13 mol/L |
| B.所加烧碱溶液的pH=13.0 |
| C.所得溶液中由水电离出的c(OH-)=10-13 mol/L |
| D.所得溶液中的c(Mg2+)=5.6×10-10 mol/L |
常温下,在BaSO4饱和溶液中加入Na2SO4固体,达到溶解平衡时,下列说法正确的是
| A.c (Ba2+) =" c" (SO42-) |
| B.c (Ba2+) 增大,c(SO42-) 减小 |
| C.c (Ba2+) ≠ c (SO42-),c(Ba2+)·c(SO42-) = KSP (BaSO4) |
| D.c (Ba2+) ≠ c (SO42-),c(Ba2+)·c(SO42-) ≠ KSP (BaSO4) |
已知下表数据:
| 物质 |
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
| Ksp(25°C) |
8.0×10-16 |
2.2×10-20 |
4.0×10-38 |
| 完全沉淀时PH范围 |
≥9.6 |
≥6.4 |
≥3.4 |
对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法,不正确的是
A.向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
B.该溶液中c(SO42-):[c(Cu2+)+c(Fe2+)+c(Fe3+)]> 5:4
C.向该溶液中加入适量氯水,并调节pH到3—4后过滤,可获得纯净的CuSO4溶液
D.在pH=5的溶液中Fe3+不能大量存在