一定条件下在固定体积的密闭容器中,能表示反应X(g)+2Y(g) 2Z(g)一定达到化学平衡状态的是
2Z(g)一定达到化学平衡状态的是
| A.X、Y、Z的物质的量之比为1∶2∶2 |
| B.X、Y、Z的浓度不再发生变化 |
| C.容器中的压强不再发生变化 |
| D.单位时间内生成n mol Z,同时生成2n mol Y |
将 4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g) 2C(g)若经 2 s(秒)后测得 C 的浓度为 0.6 mol•L-1,
2C(g)若经 2 s(秒)后测得 C 的浓度为 0.6 mol•L-1,
现有下列正确的是
| A.用物质 B 表示的反应的平均速率为 0.6 mol•L-1•s-1 |
| B.2 s 时物质 B 的浓度为 0.7 mol•L-1 |
| C.2 s 时物质 A 的转化率为70% |
| D.用物质 A 表示的反应的平均速率为 0.3 mol•L-1•s-1 |
下列有关化学反应速率的说法中,正确的是
| A.100 mL 2 mol/L的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变 |
| B.用铁片和稀硫酸反应制取氢气,改用铁片和浓硫酸可以加快产生氢气的速率 |
| C.在做草酸与高锰酸钾的反应时,加入少量硫酸锰固体可加快溶液褪色速率 |
| D.汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,若升高温度,则吸热反应速率增大,放热反应速率减小 |
工业制硫酸中的一步重要反应是SO2在400~600℃下的催化氧化:2SO2+O2  2SO3,这是一个正反应放热的可逆反应。若反应在密闭容器中进行,下述有关说法中错误的是
2SO3,这是一个正反应放热的可逆反应。若反应在密闭容器中进行,下述有关说法中错误的是
| A.使用催化剂是为了加快反应速率,提高生产效率 |
| B.达到平衡时,SO2的浓度与SO3的浓度相等 |
| C.为了提高SO2的转化率,应适当提高O2的浓度 |
| D.在上述条件下,SO2不可能100%转化为SO3 |
某化学小组研究在其他条件不变时,改变密闭容器中某一条件对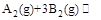
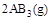 化学平衡状态的影响,得到如下图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是
化学平衡状态的影响,得到如下图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是 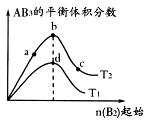
A.在 和 和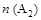 不变时达到平衡, 不变时达到平衡,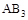 的物质的量大小为:c>b>a 的物质的量大小为:c>b>a |
B.若 > > ,则正反应一定是放热反应 ,则正反应一定是放热反应 |
C.达到平衡时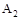 的转化率大小为:b>a>c 的转化率大小为:b>a>c |
D.若 > > ,达到平衡时b、d点的反应速率为 ,达到平衡时b、d点的反应速率为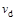 > >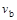 |
将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应2A(g)+B(g) 2C(g),若2 s(秒)后测得C的浓度为0.6 mol/L,现有下列几种说法:
2C(g),若2 s(秒)后测得C的浓度为0.6 mol/L,现有下列几种说法:
①用物质A表示反应的平均速率为0.3 mol/(L·s)②用物质B表示反应的平均速率为0.6 mol/(L·s)③2 s时物质A的转化率为70%④2 s时物质B的浓度为0.7 mol/L
其中正确的是
| A.①③ | B.②③ |
| C.①④ | D.③④ |
在一定温度下的容积不变的密闭容器中进行反应2X(g) 2Y(g)+Z(g),若Y浓度由0.048mol·L-1增加到0.12 mol·L-1需18s,那么由由0.12mol·L-1增加到0.2mol·L-1,需要反应的时间是
2Y(g)+Z(g),若Y浓度由0.048mol·L-1增加到0.12 mol·L-1需18s,那么由由0.12mol·L-1增加到0.2mol·L-1,需要反应的时间是
| A.等于20s | B.等于18s | C.大于20s | D.大于 18s |
在N2 + 3H2 2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6
2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6 ,在此时间内用NH3表示的反应速率为0.30
,在此时间内用NH3表示的反应速率为0.30 ·S-1。则此一段时间是:( )
·S-1。则此一段时间是:( )
| A.1秒 | B.2秒 | C.0.44秒 | D.1.33秒 |
图是可逆反应X2 + 3Y2 2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是
2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是
| A.t1时,只有正方向反应 |
| B.t2时,反应未到达限度 |
| C.t2- t3,反应不再发生 |
| D.t2- t3,各物质的浓度不再发生变化 |
反应 A(g) + 3B(g) =" 2C(g)" + 2D(g) 在不同情况下测得化学反应速率,其中最快的是( )。
A.υ(D) =" 0.4" mol/(L·S) B. υ(B) =" 0.6" mol/(L·S)
C.υ(C) =" 0.5" mol/(L·S) D. υ(A) =" 0.15" mol/(L·S)
可逆反应达到平衡的重要特征是( )。 
| A.反应停止了 | B.正、逆反应的速率均为零 |
| C.正、逆反应都还在继续进行 | D.正、逆反应的速率相等 |
在反应:C+CO2 2CO中,可使反应速率增大的措施是
2CO中,可使反应速率增大的措施是
①增大压强 ②升高温度 ③通入CO2 ④增加碳的量 ⑤降低压强
| A.①②③④ | B.②③④⑤ | C.①②③ | D.②③④ |
对已达化学平衡的下列反应 2X(g)+Y(g) 2Z(g),减小压强时,对反应产生的影响是
2Z(g),减小压强时,对反应产生的影响是
| A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动 |
| B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动 |
| C.正、逆反应速率都增大,平衡向正反应方向移动 |
| D.正、逆反应速率都减小,平衡向逆反应方向移动 |
已知合成氨反应的物质的量数据如下:
| |
N2 + 3H2  2NH3 2NH3 |
||
| 起始物质的量mol |
1.0 |
3.0 |
0 |
| 2秒末物质的量mol |
0.6 |
1.8 |
0.8 |
反应在2L容器中进行,当用氢气浓度的减少来表示该化学反应速率时,其速率为( )
A、0.2 mol/(L·s) B、0.3 mol/(L·s) C、0.6 mol/(L·s) D、0.8 mol/(L·s)