一定条件下,在容积固定的某密闭容器中发生的反应N2+3H2 2NH3。在10s内
2NH3。在10s内 的浓度由5mol/L降至4mol/L下列说法正确的是( )
的浓度由5mol/L降至4mol/L下列说法正确的是( )
A.用 表示的化学反应速率为0.1mol/(L·s) 表示的化学反应速率为0.1mol/(L·s) |
| B.使用合适的催化剂,可以加快该反应的速率 |
C.增加 的浓度或降低温度都会加快该反应的速率 的浓度或降低温度都会加快该反应的速率 |
D.反应足够长时间, 、 、 中至少有一种物质浓度降为零 中至少有一种物质浓度降为零 |
一定量的锌粉和6mol·L-1的过量盐酸反应,当向其中加入少量的下列物质:①石墨 ②CuO ③铜粉 ④铁粉 ⑤浓盐酸 ⑥无水乙酸 ⑦硝酸 ⑧CuCl2时,能够加快反应速率,又不影响产生H2总量的是
| A.①③④ | B.①③⑤ | C.②④⑧ | D.③⑤⑦ |
对于在密闭容器中发生的化学反应N2+3H3 2NH3已达平衡,如果保持其他条件不变,只增加N2的浓度,则 ( )
2NH3已达平衡,如果保持其他条件不变,只增加N2的浓度,则 ( )
| A.只有正反应速率增大 | B.逆反应速率减小 |
| C.正逆反应速率同时增大 | D.正逆反应速率同时减小 |
把镁带投入盛有盐酸的敞口容器里,在下列因素中:①盐酸的浓度②镁带的表面积 ③溶液的温度 ④氯离子的浓度。对反应速率有影响的是 ( )
| A.①② | B.③④ | C.①②③④ | D.①②③ |
对于反应A2+3B2=2C+2D来说,以下化学反应速率的表示中,反应速率最快的是 ( )
A. v(B2)="0.8" mol/ (L·s) B. v(A2)="0.4" mol/ (L·s )
C. v(C)="0.6" mol/ (L·s) D. v(D)=" 0.7" mol/ (L·s)
在容积为2L的密闭容器中,有反应:mA (g) + nB (g)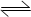 pC (g) + qD (g),经过5分钟达到平衡,此时各物质的变化为A减少为a mol /L,B的平均反应速率VB =" a/15" mol/ (L min), C增加2a / 3 mol/L,这时若增加系统压强,发现A与C的百分含量不变,则m:n:p:q为( )
pC (g) + qD (g),经过5分钟达到平衡,此时各物质的变化为A减少为a mol /L,B的平均反应速率VB =" a/15" mol/ (L min), C增加2a / 3 mol/L,这时若增加系统压强,发现A与C的百分含量不变,则m:n:p:q为( )
| A.3:1:2:2 | B.1:3:2:2 | C.1:3:2:1 | D.1:1:1:1 |
1913年德国化学家哈伯发明了以低成本制造大量氨的方法,下列是哈伯法的流程图,其中为提高原料转化率而采取的措施是
| A.①②③ | B.②④⑤ | C.①③⑤ | D.②③④ |
对于在一密闭容器中进行的下列反应:C(s)+ O2(g) CO2(g)下列说法中错误的是( )
CO2(g)下列说法中错误的是( )
| A.将木炭粉碎成粉末状可以加快化学反应速率 |
| B.升高温度可以加快化学反应速率 |
| C.增加压强可以加快化学反应速率 |
| D.增加木炭的量可以加快化学反应速率 |
下列说法正确的是( )
| A.增大反应物浓度,可增大活化分子的百分数,从而使有效碰撞次数增大 |
| B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百 分数,从而使反应速率增大 |
| C.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数 |
| D.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率 |
有效碰撞概念模型是研究化学反应速率的基础。下列说法中正确的是
| A.升高温度,有效碰撞次数增加 |
| B.发生有效碰撞时,不一定发生化学反应 |
| C.活化分子之间发生的碰撞一定为有效碰撞 |
| D.加入催化剂,分子能量不变,有效碰撞次数不变 |
研究化学反应速率有重要的意义。对于2A(g)+B(g) 3C(g)+4D(g),
3C(g)+4D(g),
下列反应速率最快的是
| A.vB=" 0.3" mol·L-1·min-1 | B.vA=" 0.5" mol·L-1·min-1 |
| C.vC=" 0.8" mol·L-1·min-1 | D.vD=" 1" mol·L-1·min-1 |
已知4NH3+5O2=4NO+6H2O,若反应速度分别用V(O2)、V(NH3)、V(NO)、V(H2O) (mol·Lˉ1·minˉ1)。则正确的关系是 ( )
A. 4/5V(NH3)=V(O2) B 5/6V(O2)=V(H2O) C.2/3V(NH3)="V(H2O)" D.4/5V(O2)=V(NO)
反应mA+nB pC中,若VA=" a" mol·Lˉ1·sˉ1,则VC为 (mol·Lˉ1·sˉ1)( )
pC中,若VA=" a" mol·Lˉ1·sˉ1,则VC为 (mol·Lˉ1·sˉ1)( )
A. |
B. |
C. |
D. |