在稀氨水中存在平衡:NH3+H2O NH
NH +OH-,如进行下列操作,则NH3、NH
+OH-,如进行下列操作,则NH3、NH 、H+、OH-浓度及PH值如何变化?(试用“增大”“减小”“不变”填写。)(1)通适量HCl气体时,c(NH3) ,c(H+) ,PH值 。
、H+、OH-浓度及PH值如何变化?(试用“增大”“减小”“不变”填写。)(1)通适量HCl气体时,c(NH3) ,c(H+) ,PH值 。
(2加入少量NaOH固体时,c(NH ) ,c(OH-) ,PH值 。
) ,c(OH-) ,PH值 。
(3)加入NH4Cl晶体时,c(NH ) ,c(OH-) 。
) ,c(OH-) 。
钾是一种活泼的金属,工业上通常用金属钠和氯化钾在高温下反应制取。该反应为:
Na(l)+KCl(l) NaCl(l)+K(g)-Q
NaCl(l)+K(g)-Q
各物质的沸点与压强的关系如下表。
| 压强/kPa |
13.33 |
53.32 |
101.3 |
| K的沸点/℃ |
590 |
710 |
770 |
| Na的沸点/℃ |
700 |
830 |
890 |
| KCl的沸点/℃ |
|
|
1 437 |
| NaCl的沸点/℃ |
|
|
1 465 |
(1)在常压下金属钾转变为气态从反应混合物中分离的最低温度约为__________,而反应的最高温度应低于__________。
(2)在制取钾的过程中,为了提高原料的转化率可以采取的措施是______________。
Ⅰ.图1是某压强下工业合成氨生产过程中,N2与H2按体积比为1:3投料时,反应混合物中氨的体积分数随温度的变化曲线,其中一条是经过一定时间反应后的曲线,另一条是平衡时的曲线。
(1)图中表示该反应的平衡曲线的是__________(填“Ⅰ”或“Ⅱ”);由图中曲线变化趋势可推知工业合成氨的反应是___________(填“吸热”或“放热”)反应。
(2)图中a点,容器内气体n(N2):n(NH3)= ____________,图中b点,v(正)_________v(逆)(填“>”、“=”或“<”)。
Ⅱ.以工业合成氨为原料,进一步合成尿素的反应原理为:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g)
CO(NH2)2(l)+H2O(g)
工业生产时,需要原料气带有水蒸汽,图2中曲线I、Ⅱ、Ⅲ表示在不同水碳比[n(H2O)/n(CO2)]时,CO2的转化率与氨碳比[n(NH3)/n(CO2)]之间的关系。
(1)写出该反应的化学平衡常数表达式____________________
(2)曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是_________,判断依据是_______________
(3)测得B点氨的转化率为40%,则x1=__________。
Ⅰ.恒温恒压下,在一体积可变的密闭容器中发生下列反应:4AC(g)+2BC2(g) 4AC2(g)+B2(g),在上述条件下,向容器中充入AC和BC2各1 mol达平衡时,生成AC2和B2共a mol,则AC的转化率是_______(用含a的代数式表示);
4AC2(g)+B2(g),在上述条件下,向容器中充入AC和BC2各1 mol达平衡时,生成AC2和B2共a mol,则AC的转化率是_______(用含a的代数式表示);
Ⅱ.若维持温度不变,在一个与Ⅰ反应前的起始体积相同容积固定的密闭容器中发生Ⅰ中所述的化学反应,开始时仍向容器中充入AC和BC2各1 mol,达平衡时生成AC2和B2共b mol,将b与Ⅰ中的a进行比较,则a_______b (填“>”“<”“=”或“不能确定”)
在一定体积的密闭容器中,进行如下化学反应:

 ,其化学平衡常数K和温度T的关系如下表:
,其化学平衡常数K和温度T的关系如下表:
| T/℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 (填“吸热”或“放热”)反应。
(3)能判断该反应已达到化学平衡状态的依据是( )
| A.容器中压强不变 | B.混合气体中 不变 不变 |
C. |
D.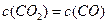 |
(4)某温度下,平衡浓度符合下式: ,试判断此时的温度为 ℃。
,试判断此时的温度为 ℃。
一定温度下,在容积为V L的密闭容器中进行反应:aM(g) bN(g),M、N的物质的量随时间的变化曲线如图所示:
bN(g),M、N的物质的量随时间的变化曲线如图所示:
(1)此反应的化学方程式中 =__________
=__________
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为:_________________________
(3)下列叙述中能说明上述反应达到平衡状态的是__________
| A.反应中M与N的物质的量之比为1︰1 |
| B.混合气体的总质量不随时间的变化而变化 |
| C.混合气体的总物质的量不随时间的变化而变化 |
| D.单位时间内每消耗a mol N,同时生成b mol M |
E.混合气体的压强不随时间的变化而变化
F.N的质量分数在混合气体中保持不变
哈伯因发明了氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖, 。右图表示某温度时,向1L容器中加入1mol氮气,3mol氢气,该反应在110S内反应进行的程度:
。右图表示某温度时,向1L容器中加入1mol氮气,3mol氢气,该反应在110S内反应进行的程度: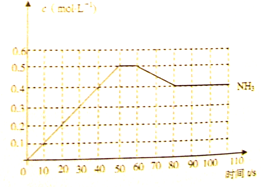
(1)此反应在50~60s时化学平衡常数为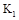 = (列出计算式不用试算)。
= (列出计算式不用试算)。
(2)反应进行到60s时,改变的条件可能是 。
| A.加入催化剂 | B.扩大容器的体积 |
| C.升高温度 | D.减小氨气的浓度 |
在该条件下,氮气的化学反应速率 (填“变小”、“变大”或“不变”)
(3)该反应在80S后化学平衡常数为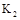 ,则
,则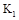
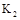 (填“>”,“<”或“=”),此时氮气的转化率为 。
(填“>”,“<”或“=”),此时氮气的转化率为 。
(4)若在110s后向该平衡体系中再加入1mol氨气,则再次达平衡后,氨气在平衡体系中的体积分数 。(填“变小”、“变大”或“不变”)
在一定温度下,10L密闭容器中加入5molSO2、3molO2,反应达平衡时有3molSO2发生了反应。试填写下列空格:
①生成SO3 mol; ②O2的转化率为 ;
③平衡时容器内气体总物质的量为 mol;
④平衡时体系中SO3的百 分含量(体积分数)为 ;
⑤若反应前容器内压强为p1,则平衡时容器内的压强为 (用p1表示)
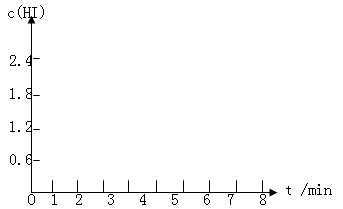
将0.8 mol I2(g)和1.2 mol H2(g)置于某1L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)  2HI(g)并达到平衡。HI的体积分数随时间的变化如表格所示:
2HI(g)并达到平衡。HI的体积分数随时间的变化如表格所示:
| HI体积分数 |
1min |
2min |
3min |
4min |
5min |
6min |
7min[ |
| 条件I |
26% |
42% |
52% |
57% |
60% |
60% |
60% |
| 条件II |
20% |
33% |
43% |
52% |
57% |
65% |
65% |
(1)在条件I到达平衡时,计算该反应的平衡常数K,要求列出计算过程。
(2)在条件I从开始反应到到达平衡时,H2的反应速率为____________。
(3)为达到条件II的数据,对于反应体系可能改变的操作是_______________。
(4)该反应的△H__________0(填">","<"或"=")
(5)在条件I下达到平衡后,在7min时将容器体积压缩为原来的一半。请在图中画出c(HI)随时间变化的曲线。
FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3净水的原理是(用离子方程式表示) 。FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示) 。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1,
c(Cl-)=5.3×10-2mol·L-1,则该溶液的PH约为 。
②完成NaClO3氧化FeCl2的离子方程式:
□ClO3―+□Fe2++□ =□Cl―+□Fe3++□ 。
(3)生成聚合氧化铁的离子方程式为:xFe3++yH2O Fex(OH)y(3x-y)++yH+ 欲使平衡正向移动可采用的方法是(填序号) 。
Fex(OH)y(3x-y)++yH+ 欲使平衡正向移动可采用的方法是(填序号) 。
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
研究氨氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)
NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)
2NO(g)+Cl2(g) 2ClNO(g) K2 ΔH2<0(Ⅱ)
2ClNO(g) K2 ΔH2<0(Ⅱ)
(1)4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=__________(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=__________(用K1、K2表示)。
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10 min时反应(Ⅱ)达到平衡。测得10 min内v(ClNO)=7.5×10-3 mol·L-1·min-1,则平衡后n(Cl2)=________mol,NO的转化率α1=_______。其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2_____α1(填“>”“<”或“=”),平衡常数K2__________(填“增大”“减小”或“不变”)。若要使K2减小,可采取的措施是______________。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH===NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1 L溶液A,溶液B为0.1 molL的CH3COONa溶液,则两溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的顺序为_________________。(已知HNO2电离常数Ka=7.1×10-4 mol·L-1,CH3COOH的电离常数Ka=1.7×10-5 mol·L-1)
可使溶液A和溶液B的pH相等的方法是____________。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
使用石油热裂解的副产物CH4来制取CO和H2,其生产流程如下图:

(1)工业上常利用反应Ⅰ产生的CO和H2合成可再生能源甲醇。
①已知CO(g)、CH3OH(l)的燃烧热分别为283.0 kJ·mol-1和726.5 kJ·mol-1,则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为 。
(2)此流程的第I步反应为:CH4(g) + H2O(g)  CO(g) + 3H2(g),一定条件下CH4的平衡转化率与温度、压强的关系如图。则P1_________P2。(填“<”、“>”或“=”)100℃时,将1 mol CH4和2 mol H2O通入容积为10L的恒容密闭容器中,达到平衡时CH4的转化率为0.5。此时该反应的平衡常数K=____________。
CO(g) + 3H2(g),一定条件下CH4的平衡转化率与温度、压强的关系如图。则P1_________P2。(填“<”、“>”或“=”)100℃时,将1 mol CH4和2 mol H2O通入容积为10L的恒容密闭容器中,达到平衡时CH4的转化率为0.5。此时该反应的平衡常数K=____________。

(3)此流程的第II步反应CO(g) + H2O(g)  CO2(g) + H2(g),
CO2(g) + H2(g),
的平衡常数随温度的变化如下表:
| 温度/℃ |
400 |
500[ |
830 |
| 平衡常数K |
10 |
9 |
1 |
从上表可以推断:该反应是 反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,反应达到平衡时,CO的转化率为 。
右图表示该反应在t1时刻达到平衡、在t2时刻因改变某个条件引起浓度变化的情况:图中t2时刻发生改变的条件是____(写出一种)。

(4)某化学兴趣小组构想将NO转化为HNO3(NO3-),装置如图,电极为多孔惰性材料。则负极的电极反应式是 。

恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2 (g) + 3 H2(g)  2NH3(g)
2NH3(g)
(1)若反应某时刻t时,n t (N2) =" 13" mol,n t (NH3) =" 6" mol,则a =__________mol;
(2)反应达平衡时,混合气体的体积为716.8 L(标况下),其中NH3的含量(体积分数)为25%,平衡时NH3的物质的量__________;
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比、下同),n(始)∶n(平) =__________;
(4)原混合气体中,a∶b =__________;
(5)达到平衡时,N2和H2的转化率之比,α(N2)∶α(H2)= __________;
(6)平衡混合气体中,n(N2)∶n(H2)∶n(NH3) =__________________。
在4L体积不变的密闭 容器中充入6molA气体和5molB气体,发生反应:
容器中充入6molA气体和5molB气体,发生反应:
3A (g) + B (g)  2C (g) + x D (g), 2分钟后反应达到平衡,生成了2molC,经测定D的浓度为0.25mol·L-1, 求:
2C (g) + x D (g), 2分钟后反应达到平衡,生成了2molC,经测定D的浓度为0.25mol·L-1, 求:
(1) x= 。
(2) 用B表示的2分钟内的平均反应速率______________________。
(3)达到平衡时 ,在相同温度下容器内混合气体的压强与反应前压强比为 。
,在相同温度下容器内混合气体的压强与反应前压强比为 。
(4)达到平衡状态时B的转化率为 。
已知在催化剂存在条件下,能发生如下反应:
CO + H2O(g)  H2 + CO2 + Q
H2 + CO2 + Q
(1)在5 L盛有固体催化剂(其体积可忽略不计)的密闭容器中,通入反应物,10 s后,生成了氢气0.2 g,则此10 s内CO的平均反应速率为v(CO) = ____ _0.002 mol/Ls______。
(2)在该密闭容器中,下列叙述可以说明反应已经达到平衡状态的是__ BC___
A.若容器体积不变,在一定温度下压强达到恒定
B.CO2的生成速率与H2O蒸气的生成速率之比为1 : 1
C.CO、H2O、H2、CO在容器中的物质的量浓度保持不变
D.反应体系中混合物的平均摩尔质量保持不变
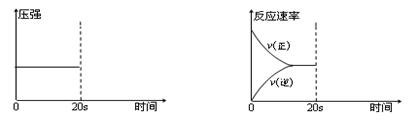
(3)在上述反应达平衡状态后,分别改变条件,请完成下列两张图:
A.在第20 s时将容器体积缩小至 B.在第20 s时,向容器中注入少量的
原来的一半后压强变化图 CO气体后正逆反应速率变化图