(11分)已知某气体反应的平衡常数可表示为K= ,该反应在不同温度下的平衡常数:400℃,K=32;500℃,K=44.
,该反应在不同温度下的平衡常数:400℃,K=32;500℃,K=44.
请回答下列问题:
(1)写出上述反应的化学方程式______________________________.
(2)该反应的正反应是__________反应(填“放热”或者“吸热”),
(3)已知在密闭容器中,测得某时刻各组分的浓度如下:

①此时系统温度400℃,比较正、逆反应速率的大小:v正__________v逆(填“>”、“<”或“=”).
②若以甲醇百分含量为纵坐标,以温度为横坐标,此时反应点在图象的位置是图中___________点.比较图中B、D两点所对应的正反应速率B__________D(填“>”、“<”或 “=”).理由是__________.

(4)一定条件下要提高反应物的转化率,可以采用的措施是__________
a.升高温度 b.加入催化剂 c.压缩容器的体积
d.增加水蒸气的浓度 e.及时分离出产物
苯硫酚(PhSH)是一种用途广泛的有机合成中间体。工业上用常用氯苯(PhCl)和硫化氢(H2S)在高温下反应来制备苯硫酚,但会有副产物苯(PhH)生成。
I: PhCl(g)+H2S(g) PhSH(g)+HCl(g) △H1=—16.8kJ·mol-1
PhSH(g)+HCl(g) △H1=—16.8kJ·mol-1
II: PhCl(g)+H2S(g) ==PhH(g)+ HCl(g)+ S8(g) △H2
S8(g) △H2
回答下列问题:
(1)反应I为可逆反应,写出平衡常数的表达式K=_______________________,
反应II为不可逆反应,△H2=___________0。(填写“>”,“<”,“=”)

(2)上述两个反应的能量变化如图一所示,则在某温度时反应速度v(I)__________v(II)(填写“>”,“<”,“=”)
(3)现将一定量的氯苯和硫化氢置于一固定容积的容器中模拟工业生产过程,在不同温度下均反应20分钟测定生成物的浓度,得到图二和图三。
①请解释图二中两条曲线的变化_______________________。
②若要提高主产物苯硫酚的产量,可采取的措施是______________________。
(4)请根据图二、图三,画出恒温恒容条件下反应主产物苯硫酚的物质的量随时间变化的曲线图。

一定温度下可逆反应:A(s)+2B(g) 2C(g)+D(g);△H>0。现将1molA和2molB加入甲容器中,将4 molC和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
2C(g)+D(g);△H>0。现将1molA和2molB加入甲容器中,将4 molC和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是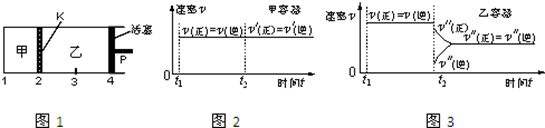
| A.保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 |
| B.保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增加 |
| C.保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 |
| D.保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |
为实现 “节能减排” 和“低碳经济”的一项课题是如何将CO2转化为可利用资源。目前,工业上常用CO2来生产燃料甲醇。现进行如下实验:在体积为l L的密闭恒容容器中,充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)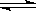 CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
(1)该反应的平衡常数表达式K= ;
(2)从反应开始到平衡时,CH3OH的平均反应速率v(CH3OH)= (注明单位);H2的转化率= ;
(3)下列说法中,能说明上述反应达到平衡状态的是
A.每消耗1mol CO2的同时生成1mol CH3OH
B.CO2、H2、CH3OH和H2O的物质的量的比为1:3:1:1
C.容器中气体的压强不再改变
D.容器中气体的密度不再改变
(4)下列措施中,能使上述平衡状态向正反应方向移动的是
A.升高温度
B.将CH3OH(g)从体系中分离
C.使用高效催化剂
D.恒温恒容再充入1 molCO2和3 mol H2
目前,消除氮氧化物污染有多种方法。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4 (g)+4NO2 (g)=4NO(g)+CO2 (g)+2H2 O(g) ΔH=-574 kJ·mol-1
②CH4 (g)+4NO(g)=2N2 (g)+CO2 (g)+2H2 O(g) ΔH=-1160 kJ·mol-1
③H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式__________
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2 (g)+CO2 (g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温条件下反应,反应进行到不同时间测得各物质的浓度如下
N2 (g)+CO2 (g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温条件下反应,反应进行到不同时间测得各物质的浓度如下
| 浓度/mol·L-1 时间/min |
NO |
N2 |
CO2 |
| 0 |
0.100 |
0 |
0 |
| 10 |
0.058 |
0.021 |
0.021 |
| 20 |
0.040 |
0.030 |
0.030 |
| 30 |
0.040 |
0.030 |
0.030 |
| 40 |
0.032 |
0.034 |
0.017 |
| 50 |
0.032 |
0.034 |
0.017 |
①不能作为判断反应达到化学平衡状态的依据是_______
A.容器内CO2的浓度保持不变
B.v正(N2)="2" v正(NO)
C.容器内压强保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量保持不变
②在该温度下时.该反应的平衡常数为 (保留两位小数);
③在30 min,改变某一条件,反应重新达到平衡,则改变的条件是_____________。
(3)合成塔失去活性的铬锌触媒可用于制备锌锰电池。在碱性条件下,该电池的总反应为: Zn(s) +2MnO2 (s) +H2O(l) = Zn(OH)2 (s) +Mn2O3(s) ,该电池正极的电极反应式是 。PbO2可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生反应的电极反应式为 ,阴极上观察到的现象是; 若电解液中不加入Cu(NO3)2这样做的主要缺点是 。
(16分)氮氧化合物是目前造成大气污染的主要气体。NO在空气中存在如下反应:
2NO(g) + O2(g)  2NO2(g) ΔH
2NO2(g) ΔH
(1)上述反应分两步完成,其中第一步反应①如下,写出第二步反应②的热化学方程式(其反应的焓变ΔH2用含ΔH、ΔH1的式子来表示):
①2NO(g)  N2O2(g) ΔH1<0 ②__________________________
N2O2(g) ΔH1<0 ②__________________________
(2)在某温度下的一密闭容器中充入一定量的NO2,测得NO2的浓度随时间的变化曲线如下图所示,前5 秒内的O2的平均生成速率为___________________mol•L-1•s-1,该条件下反应:2NO + O2 2NO2的化学平衡常数数值为_________________,平衡后某时刻,升高反应体系的温度,建立新平衡状态后,测的混合气体的平均相对分子质量小于原平衡状态,则:
2NO2的化学平衡常数数值为_________________,平衡后某时刻,升高反应体系的温度,建立新平衡状态后,测的混合气体的平均相对分子质量小于原平衡状态,则:
2NO(g) + O2(g)  2NO2(g) ΔH______0(填“<”或 “>”);
2NO2(g) ΔH______0(填“<”或 “>”);
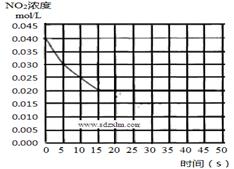
(3)2NO(g) + O2(g)  2NO2(g)的两步反应中,反应①的反应速率数值较大,是一个快反应,会快速建立平衡状态,而反应②是一个慢反应,则决定反应2NO(g) + O2(g)
2NO2(g)的两步反应中,反应①的反应速率数值较大,是一个快反应,会快速建立平衡状态,而反应②是一个慢反应,则决定反应2NO(g) + O2(g)  2NO2(g)反应速率的是反应__________(填”①”或“②”)。对(2)中反应体系升高温度的过程中,发现2NO(g) + O2(g)
2NO2(g)反应速率的是反应__________(填”①”或“②”)。对(2)中反应体系升高温度的过程中,发现2NO(g) + O2(g)  2NO2(g)的反应速率变慢,结合该反应的两步反应过程分析可能的原因__________________________(反应未使用催化剂)。
2NO2(g)的反应速率变慢,结合该反应的两步反应过程分析可能的原因__________________________(反应未使用催化剂)。
(4)若(2)中反应体系,反应开始时使用催化剂,请在(2)的图中画出该反应体系反应进程可能的曲线。
(5)电解法处理氮氧化合物是目前大气污染治理的一个新思路,原理是将NOx在电解池中分解成无污染的N2和O2除去,如右图示,两电极间是固体氧化物电解质,在一定条件下可自由传导O2-,电解池阴极反应为__________________。
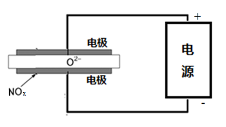
氢气是一种清洁能源,氢气的制取是氢能源利用领域的研究热点。
(1)纳米级的Cu2O可作为太阳光分解水的催化剂。一定温度下,在2L密闭容器中加入纳米级Cu2O并通入0.10mol水蒸气发生反应:2H2O(g)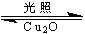 2H2(g)+O2(g)△H = +484kJ·mol—1,不同时段产生O2的量见下表:
2H2(g)+O2(g)△H = +484kJ·mol—1,不同时段产生O2的量见下表:
| 时间/min |
20 |
40 |
60 |
80 |
| n(O2)/mol |
0.0010 |
0.0016 |
0.0020 |
0.0020 |
上述反应过程中能量转化形式为光能转化为 能,达平衡过程中至少需要吸收光能为 kJ。
(2)现有反应:CO(g)+ H2O(g) 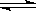 CO2(g)+ H2(g) △H<0,在相同温度和相同体积下进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:
CO2(g)+ H2(g) △H<0,在相同温度和相同体积下进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:
| 物质的量 |
CO |
H2 O |
CO2 |
H2 |
| 甲 |
a mol |
a mol |
0 mol |
0 mol |
| 乙 |
0mol |
0 mol |
2a mol |
a mol |
| 丙 |
0 mol |
0 mol |
a mol |
a mol |
| 丁 |
a mol |
a mol |
a mol |
a mol |
上述四种情况达到平衡后,甲、乙、丙、丁容器中n(CO)的大小顺序为 。
(3)金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3得金属钨,总反应为WO3 (s) + 3H2 (g) W (s) + 3H2O (g)。请回答下列问题:
W (s) + 3H2O (g)。请回答下列问题:
①某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为 。
②上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
| 温度 |
25℃ ~ 550℃ ~ 600℃ ~ 700℃ |
| 主要成份 |
WO3 W2O5 WO2 W |
假设WO3完全转化为W,则三个阶段消耗H2物质的量之比为 。
③钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W (s) +2I2 (g)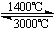 WI4 (g)。下列说法正确的有 (填字母)。
WI4 (g)。下列说法正确的有 (填字母)。
A.灯管内的I2可循环使用
B.WI4在灯丝上分解,产生的W又沉积在灯丝上
C.WI4在灯管壁上分解,使灯管的寿命延长
D.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
NH3及其盐都是重要的化工原料。
(1)用NH4Cl和Ca(OH)2制备NH3,反应发生、气体收集和尾气处理装置依次为 、 、 (填字母)。

(2)恒定温度下在特制的密闭真空容器中充入2molNH3、1molCO2,发生反应制备氨基甲酸铵 2NH3(g)+CO2(g)  NH2COONH4(s)(假设固体试样体积忽略不计)。若容器体积不变,可以判断该反应已经达到化学平衡的是 (填字母)。
NH2COONH4(s)(假设固体试样体积忽略不计)。若容器体积不变,可以判断该反应已经达到化学平衡的是 (填字母)。
A.υ(NH3)= 2υ(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
上述反应达到平衡后,若在恒温下压缩容器体积,重新达平衡后混合气体中NH3的体积分数 (填“增加”、“减小”或“不变”)。
(3)铵盐在水溶液中建立如下水解平衡:NH4Cl+H2O NH3·H2O+HCl,研究表明,浓度、温度、pH均对铵盐水解程度(即上述反应中中NH4Cl的转化率)产生影响。某兴趣小组探究某一种因素对溶液中NH4Cl水解程度的影响。
NH3·H2O+HCl,研究表明,浓度、温度、pH均对铵盐水解程度(即上述反应中中NH4Cl的转化率)产生影响。某兴趣小组探究某一种因素对溶液中NH4Cl水解程度的影响。
试剂与仪器:固体NH4Cl、蒸馏水、100mL容量瓶、烧杯、胶头滴管、玻璃棒、药匙、天平、pH计、温度计、恒温水浴槽(可控制温度)。
设计实验方案,pH为拟测定的数据,表中V(溶液)表示所配制NH4Cl溶液的体积。
| 物理量 实验序号 |
V(溶液)/mL |
NH4Cl /g |
温度/℃ |
pH |
… |
| 1 |
100 |
m |
T1 |
|
… |
| 2 |
100 |
m |
T2 |
|
… |
| 3 |
100 |
2m |
T2 |
|
… |
请分析,实验1、2的目的是探究 对溶液中NH4Cl水解程度的影响,实验2、3的目的是探究 对溶液中NH4Cl水解程度的影响。
煤是一种重要的化工原料,人们将利用煤制取的水煤气、焦炭、甲醚等广泛用于工农业生产中。
(1)已知:
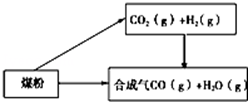
①C(s)+H2O(g)═CO(g)+H2(g) △H=+131.3kJ·mol﹣1
②CO2(g)+H2(g)═CO(g)+H2O(g) △H=+41.3kJ·mol﹣1
则碳与水蒸气反应生成二氧化碳和氢气的热化学方程式为 。
该反应在 (填“高温”、“低温”或“任何温度”)下有利于正向自发进行.
(2)有人利用炭还原法处理氮氧化物,发生反应C(s)+2NO(g) N2(g)+CO2(g).向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得各物质的浓度如下表所示:
N2(g)+CO2(g).向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得各物质的浓度如下表所示:
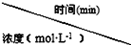 |
0 |
10 |
20 |
30 |
40 |
50 |
| NO |
1.00 |
0.68 |
0.50 |
0.50 |
0.60 |
0.60 |
| N2 |
0 |
0.16 |
0.25 |
0.25 |
0.30 |
0.30 |
| CO2 |
0 |
0.16 |
0.25 |
0.25 |
0.30 |
0.30 |
①10~20min内,N2的平均反应速率v(N2)= .
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是__________(填字母序号).
A.通入一定量的NO B.加入一定量的活性炭
C.加入合适的催化剂 D.适当缩小容器的体积
(3)研究表明:反应CO(g)+H2O(g) H2(g)+CO2(g)平衡常数随温度的变化如下表所示:
H2(g)+CO2(g)平衡常数随温度的变化如下表所示:
| 温度/℃ |
400 |
500 |
800 |
| 平衡常数K |
9.94 |
9 |
1 |
若反应在500℃时进行,设起始时CO和H2O的浓度均为0.020mol·L﹣1,在该条件下达到平衡时,CO的转化率为 .
(4)用CO做燃料电池电解CuSO4溶液、FeCl3和FeCl2混合液的示意图如图1所示,其中A、B、D均为石墨电极,C为铜电极.工作一段时间后,断开K,此时A、B两极上产生的气体体积相同.
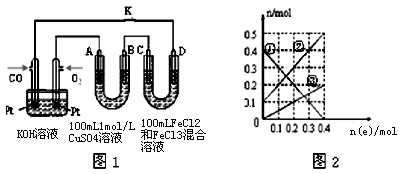
①乙中A极产生的气体在标准状况下的体积为 .
②丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图2所示,则图中③线表示的是 (填离子符号)的变化;反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要 mL 5.0mol·L﹣1 NaOH溶液.
研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义。
(1) I2O5可使H2S、CO、HCl等氧化,常用于定量测定CO的含量。已知:
2I2(s)+5O2(g) 2I2O5(s) ΔH="-75.56" kJ·mol-1
2I2O5(s) ΔH="-75.56" kJ·mol-1
2CO(g)+O2(g) 2CO2(g) ΔH="-566.0" kJ·mol-1
2CO2(g) ΔH="-566.0" kJ·mol-1
写出CO(g)与I2O5(s)反应生成I2(s)和CO2(g)的热化学方程式: 。
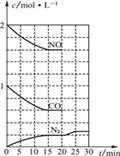
(2) 降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:
2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH<0
N2(g)+2CO2(g) ΔH<0
①该反应的化学平衡常数表达式为K= 。
②一定条件下,将体积比为1∶2的NO、CO气体置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 (填字母)。
a. 体系压强保持不变
b. 混合气体颜色保持不变
c. N2和CO2的体积比保持不变
d. 每生成1 mol N2的同时生成2 mol NO
③若在一定温度下,将2 mol NO、1 mol CO充入1 L固定容积的容器中, 反应过程中各物质的浓度变化如下图所示。若保持温度不变,20 min时再向 容器中充入CO、N2各0.6 mol,平衡将 (填“向左”、“向右”或“不”)移动。20 min时,若改变反应条件,导致N2浓度发生如右图所示的变化,则改变的条件可能是 (填字母)。a. 加入催化剂 b. 降低温度 c. 增加CO2的量
肼(N2H4)与N2O4,是火箭发射中最常用的燃料与助燃剂。
(1)已知2N2H4(l)+ N2O4(l)= 3N2(g) +4H2O(l) △H=-1225KJ/mol

则使1 mol N2O4(l)完全分解成相应的原子时需要吸收的能量是 。
(2)800℃时,某密闭容器中存在如下反应:2NO2(g)  2NO(g) +O2(g) △H>0,若开始向容器中加入1 mol/L的NO2,反应过程中NO的产率随时间的变化如下图曲线I所示。
2NO(g) +O2(g) △H>0,若开始向容器中加入1 mol/L的NO2,反应过程中NO的产率随时间的变化如下图曲线I所示。

①反应Ⅱ相对于反应I而言,改变的条件可能是 。
②请在图中绘制出在其它条件与反应I相同时,反应在820℃时进行,NO的产率随时间的变化曲线。
③800℃时,若开始时向容器中同时加入1 mol/L NO、0.2 mol/L O2、0.5 mol/L NO2,则v(正) v(逆)。
(3)己知N2O4(g)  2NO2(g) △H=+57.20kJ/mol,t时,将一定量的NO2、N2O4,充人一个容器为2L的恒容密闭容器中,浓度随时间变化关系如下表所示:
2NO2(g) △H=+57.20kJ/mol,t时,将一定量的NO2、N2O4,充人一个容器为2L的恒容密闭容器中,浓度随时间变化关系如下表所示:

①c( X)代表 (填化学式)的浓度,该反应的平衡常数K= 。
②前10 min内用NO2表示的反应速率为 ,20 min时改变的条件是 ;重新达到平衡时,NO2的百分含量 (填选项前字母)。
a.增大 b.减小 c.不变 d.无法判断
(14分)以硫铁矿(主要成分为FeS2)为原料制取硫酸,其烧渣可用来炼铁。
(1)煅烧硫铁矿时发生反应:FeS2+O2―→Fe2O3+SO2(未配平)。当产生448 L(标准状况)SO2时,消耗O2的物质的量为____________。
(2)Fe2O3用CO还原焙烧的过程中,反应物、生成物和温度之间的关系如图所示。

(图中Ⅰ、Ⅱ、Ⅲ、Ⅳ四条曲线是四个化学反应平衡时的气相组成对温度作图得到的;A、B、C、D四个区域分别是Fe2O3、Fe3O4、FeO、Fe稳定存在的区域)
已知:3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g);ΔH1=a kJ·mol-1
Fe3O4(s)+CO(g)===3FeO(s)+CO2(g);ΔH2=b kJ·mol-1
FeO(s)+CO(g)===Fe(s)+CO2(g);ΔH3=c kJ·mol-1
① 反应Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g)的ΔH=____________kJ·mol-1(用含a、b、c的代数式表示)。
②800 ℃时,混合气体中CO2体积分数为40%时,Fe2O3用CO还原焙烧反应的化学方程式为__________________。
③ 据图分析,下列说法正确的是___________ (填字母)。
a. 温度低于570℃时,Fe2O3还原焙烧的产物中不含FeO
b. 温度越高,Fe2O3还原焙烧得到的固体物质组成中Fe元素的质量分数越高
c. Fe2O3还原焙烧过程中及时除去CO2有利于提高Fe的产率
(3) FeS2是Li/FeS2电池(示意图如图)的正极活性物质。
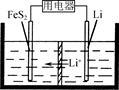
①FeSO4、Na2S2O3、S及H2O在200 ℃时以等物质的量连续反应24 h后得到FeS2。写出该反应的离子方程式: 。
②Li/FeS2电池的负极是金属Li,电解液是含锂盐的有机溶液。电池放电反应为FeS2+4Li===Fe+4Li++2S2-。该反应可认为分两步进行:第1步,FeS2+2Li===2Li++FeS22-,则第2步正极的电极反应式为____________________。
(14分) 二氧化碳与氢气催化合成甲醇,发生的反应为:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
(1)已知:
| 化学键 |
H-H |
C-O |
C=O |
H-O |
C-H |
| 键能/kJ·mol-1 |
436 |
326 |
803 |
464 |
414 |
计算上述反应的△H= kJ.mol-1。
(2)一定条件下,将n(CO2):n(H2)=1:1的混合气充入恒温恒容密闭容器中,下列事实可以说明该反应已达平衡的是 (填选项字母)。
A.容器内气体密度保持不变
B.CO2的体积分数保持不变
C.H2O(g)与CO2(g)的生成速率之比为1∶1
D.该反应的平衡常数保持不变
E.混合气体的平均相对分子质量不变
F.容器中压强保持不变
(3)一定条件下,往2L恒容密闭容器中充入1.2molCO2和3.6molH2,在不同催化剂作用下的反应I、反应II与反应III,相同时间内CO2转化率随温度变化的数据如表所示,据表中数据绘制“图1”:
| 相同时间内CO2转化率 |
T1 |
T2 |
T3 |
T4 |
T5 |
| 反应Ⅰ |
65% |
77% |
80% |
80% |
66.67% |
| 反应Ⅱ |
56% |
67% |
76% |
80% |
66.67% |
| 反应Ⅲ |
48% |
62% |
72% |
80% |
66.67% |

(T5时,图1中C点转化率为66.67%,即转化了2/3)
①催化剂效果最佳的反应是 (填“反应I”,“反应II”,“反应III”)。
②T3的b点v(正) v(逆)(填 “>”, “<”, “="”" )。
③T4的a点转化率比T5的c点高的原因是 。
④在温度为T5时,该反应的平衡常数K= 。
⑤在温度为T5时,CH3OH的浓度随时间变化的趋势如“图2”所示。
当时间到达t1时,将生成的甲醇和水同时除去,并维持该温度,在 t2时达新平衡。
请在“图2”中画出t1时刻后CH3OH的浓度变化总趋势曲线。
甲醇(CH3OH)是一种重要的化工原料,也是一种比较理想的燃料。甲醇在各个领域有着广泛的应用。
(1)实验测得:32 g甲醇在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出726.4 kJ的热量,试写出甲醇燃烧的热化学方程式:_________________________。
(2)燃料电池是一种连续地将燃料和氧化剂的化学能直接转换成电能的化学电池。下图是一个化学过程的示意图。2CH3OH+3O2+4KOH K2CO3+6H2O
K2CO3+6H2O

①A(石墨)电极的名称是 。
②通入O2的电极的电极反应式是________________
③写出通入CH3OH的电极的电极反应式是 。
④乙池中反应的化学方程式为 。
⑤当电路中通过0.01mol电子时,丙池溶液的C(H+) = mol/L(忽略电解过程中溶液体积的变化)。
(3)合成甲醇的主要反应是:2H2(g)+ CO(g) CH3OH(g) △H="—90.8" kJ·mol—1。
CH3OH(g) △H="—90.8" kJ·mol—1。
①在恒温恒容条件下,充入一定量的H2和CO,发生反应2H2(g)+ CO(g) CH3OH(g)。则该反应达到平衡状态的标志有
CH3OH(g)。则该反应达到平衡状态的标志有
a.混合气体的密度保持不变 b.混合气体的总压强保持不变
c.CO的质量分数保持不变 d.甲醇的浓度保持不变
e.v正(H2)= v逆(CH3OH) f.v(CO)= v(CH3OH)
②要提高反应2H2(g)+ CO(g) CH3OH(g)中CO的转化率,可以采取的措施是:
CH3OH(g)中CO的转化率,可以采取的措施是:
a.升温 b.加入催化剂
c.增加CO的浓度 d.加入H2
e.加入惰性气体 f.分离出甲醇
(14分)请回答下列问题:
(1)下表列出了一些化学键的键能E:
| 化学键 |
H—H |
O===O |
O—H |
| E/kJ·mol-1 |
436 |
x |
463 |
反应H2(g)+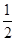 O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1,则x=__________。
O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1,则x=__________。
(2)铅蓄电池是正极板上覆盖有PbO2,负极板上覆盖有Pb,电解质溶液是H2SO4溶液,电池放电时的总反应:Pb+PbO2+2H2SO4=2PbSO4+2H2O。
请写出充电时阴极的电极反应式:__________________
(3)反应m A+n B p C,在某温度下达到平衡。
p C,在某温度下达到平衡。
①若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关系是________________。
②若C为气体,且m + n = p,在加压时化学平衡发生移动,则平衡必定向________________方向移动。
③若再升高温度,平衡向逆向移动,则正反应为 _________ 反应(填“吸热”或“放热”)
(4)依据氧化还原反应Zn(s)+Cu2+(aq)===Zn2+(aq)+Cu(s)设计的原电池如图所示。

①请在图中标出电极材料及电解质溶液(写化学式)________________
②盐桥中的Cl-向________极移动(填“左”或“右”)。