合成氨需要的H2由煤和水反应制得,其中一步反应为:CO(g)+H2O(g) CO2(g)+H2(g) △H>0,要使CO转化率提高,可采取( )
CO2(g)+H2(g) △H>0,要使CO转化率提高,可采取( )
| A.增大H2O(g)的浓度 | B.增大CO的浓度 |
| C.降低温度 | D.增大压强 |
在合成氨工业中,为增加NH3的日产量,实施下列目的的变化过程中与平衡移动无关的是( )
| A.不断将氨分离出来 | B.使用催化剂 |
| C.采用500℃左右的高温 | D.采用2×107~5×107Pa的压强 |
可逆反应N2+3H2 2NH3 △H<0,达到平衡后,为使H2的转化率增大,下列说法正确的是( )
2NH3 △H<0,达到平衡后,为使H2的转化率增大,下列说法正确的是( )
| A.升高温度,降低压强,增加氮气 |
| B.降低温度,增大压强,加入催化剂 |
| C.升高温度,增大压强,增加氮气 |
| D.降低温度,增大压强,分离部分氨 |
工业上用氨和二氧化碳反应合成尿素。已知下列物质在一定条件下均能与水反应产生H2和CO2,H2是合成氨的原料,CO2供合成尿素使用。若从充分利用原料的角度考虑,最好选用的原料是( )
| A.CO | B.石脑油(C5H12、C6H14) | C.CH4 | D.焦碳 |
在N2+3H2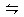 2NH3 △H<0的平衡体系中,当分离出NH3时,下列说法正确的是( )
2NH3 △H<0的平衡体系中,当分离出NH3时,下列说法正确的是( )
| A.反应速率增大 | B.平衡向逆反应方向移动 |
| C.平衡体系中NH3的含量增大 | D.N2的转化率增大 |
下列有关合成氨工业的叙述中,可用勒夏特列原理解释的是( )
| A.使用铁触媒,有利于合成氨 |
| B.高压比低压条件更有利于合成氨的反应 |
| C.500℃左右的温度比室温更有利于合成氨的反应 |
| D.及时移走NH3 |
在固定体积的密闭容器中进行如下反应N2+3H2 2NH3 △H<0:,若将平衡体系中各物质的浓度都增大到原来的2倍,则产生的结果是( )
2NH3 △H<0:,若将平衡体系中各物质的浓度都增大到原来的2倍,则产生的结果是( )
①平衡不移动;②平衡右移;③平衡左移;④NH3的百分含量增加;⑤υ(正)、υ(逆)均增大。
| A.①⑤ | B.①②⑤ | C.③⑤ | D.②④⑤ |
NH3氧化制硝酸时,在吸收塔里发生如下反应:3NO2+3H2O  2HNO3+NO △H<0,为了提高HNO3的产量,在理论上应该采取的措施是( )
2HNO3+NO △H<0,为了提高HNO3的产量,在理论上应该采取的措施是( )
| A.降温 | B.升温 | C.减压 | D.增压 |
能使合成氨反应:N2+3H2 2NH3 △H<0,进行程度增大的是( )
2NH3 △H<0,进行程度增大的是( )
| A.升高温度 | B.降低压强 |
| C.使用催化剂 | D.及时分离出NH3 |
已知真空炼铷的原理如下:2RbCl+Mg = MgCl2+2Rb(g)。对于此反应的进行能给予正确解释的是( )
| A.铷的金属活动性不如镁强,镁可置换出铷 |
| B.铷的沸点比镁低,把铷蒸气抽出时,平衡向右移 |
| C.铷的单质状态较化合态更稳定 |
| D.MgCl2的热稳定性不如RbCl强 |
已知2SO2(g)+O2(g) 2SO3(g);△H<0的实验数据如下表:
2SO3(g);△H<0的实验数据如下表:
| 温度 |
不同压强下SO2的转化率(%) |
||||
| 1×105Pa |
5×105Pa |
1×106Pa |
5×106Pa |
1×107Pa |
|
| 450℃ |
97.5 |
98.9 |
99.2 |
99.6 |
99.7 |
| 550℃ |
85.6 |
92.9 |
94.9 |
97.7 |
98.3 |
⑴应选的温度是 。
⑵应采用的压强是 ,理由是 。
⑶在合成的SO3过程中,不需要分离出SO3的原因是 。
.当下列反应达到平衡时,保持温度不变,向容器中通Ar,化学平衡一定不移动的是( )
A.PCl5(g) 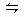 PCl3(g)+Cl2(g) PCl3(g)+Cl2(g) |
B.N2(g)+3H2(g)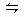 2NH3(g) 2NH3(g) |
C.2HI(g) 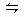 H2(g)+I2(g) H2(g)+I2(g) |
D.C2H4(g)+H2(g)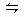 C2H6(g) C2H6(g) |
化学反应C(s)+H2O(g) 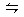 CO(g)+H2(g) ΔH>0达到平衡,下列叙述中正确的是 ( )
CO(g)+H2(g) ΔH>0达到平衡,下列叙述中正确的是 ( )
| A.升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动 |
| B.加入固体碳,平衡向正反应方向移动 |
| C.加入水蒸气使容器内压强增大,平衡向逆反应方向移动 |
| D.扩大容器容积,平衡向正反应方向移动 |
α1和α2分别为A在两个恒容容器中平衡体系A(g) 2B(g)和2A(g)
2B(g)和2A(g) B(g)的转化率,在温度不变的情况下,均增加A的物质的量,下列判断正确的是( )
B(g)的转化率,在温度不变的情况下,均增加A的物质的量,下列判断正确的是( )
| A.α1、α2均增大 | B.α1、α2均减小 |
| C.α1减小、α2增大 | D.α1增大、α2减小 |