【化学-化学与技术】
海洋是化学资源宝库,海洋资源的综合利用具有广阔的前景。回答下列问题:
(1)蒸馏法是人类最早使用的淡化海水的方法,技术和工艺比较完备,但常规蒸馏法法也存在较大缺陷,请说明常规蒸馏法淡化海水的最大缺陷。
__________________________________________________________
(2)离子交换法也是常用的水处理技术。聚丙烯酸钠是一种离子交换树脂,写出聚丙烯酸钠单体的结构简式 。
(3)目前从海水中提取溴的常用流程如下(苦卤,海水蒸发结晶分离出食盐的母液):
从反应③后的溶液中分离出单质溴的方法是 。
(4)海水提镁过程中,与石灰窑和盐酸厂有着紧密的联系,试说明海水提镁与盐酸厂之间的必然联系。__________________________________________________________
下列各组中两个变化所发生的反应,属于同一类型的是
①由甲苯制甲基环己烷、由乙烷制溴乙烷②乙烯使溴水褪色、乙炔使酸性高锰酸钾溶液褪色③由乙烯制聚乙烯、由2-甲基-1,3-丁二烯制天然橡胶;④由苯制硝基苯、由乙烷制硝基乙烷。
| A.只有②③ | B.只有③④ | C.只有①③ | D.只有①④ |
除去下列物质中的杂质(括号中为杂质),采用的试剂和除杂方法错误的是
| 序号 |
待除杂质 |
试剂 |
除杂方法 |
| A |
CH3CH2Br(C2H5OH) |
水 |
分液 |
| B |
C2H6(C2H4) |
酸性KMnO4溶液 |
洗气 |
| C |
C6H6(Br2) |
NaOH溶液 |
分液 |
| D |
C2H2(H2S) |
CuSO4溶液 |
洗气 |
(8分) 下图是实验室制备乙酸乙酯的实验装置。试回答:
(1)试管甲中加入的试剂顺序是( )
A.乙醇、浓硫酸、乙酸
B.浓硫酸、乙醇、乙酸
C.浓硫酸、乙酸、乙醇
(2)甲处的试管内发生反应的化学方程式为:
(3)小试管乙中饱和Na2CO3的作用是( )
A、吸收乙醇
B、中和乙酸
C、增大溶液密度,降低乙酸乙酯在里面的溶解度
(4)乙装置中的导管未插入溶液的目的是 。
四氯化钛是无色液体,沸点为136℃。它极易水解,遇空气中水蒸气即产生“白烟”(TiCl4+H2O TiOCl2+2HCl↑)。在650~850℃下,将氯气通过二氧化钛和炭粉的混合物可得到四氯化钛和一种有毒气体。下图是实验室制备TiCl4的部分装置。
TiOCl2+2HCl↑)。在650~850℃下,将氯气通过二氧化钛和炭粉的混合物可得到四氯化钛和一种有毒气体。下图是实验室制备TiCl4的部分装置。
请回答:
(1)B装置中试剂为 ,其作用是 (每空l分)。
(2)C装置中的反应方程式为 。
(3)D装置中冷凝水的方向为 进 出,该装置的作用为 。
(4)评价此装置的缺陷和不妥之处(每空2分):
| 编号 |
装置缺陷和不妥之处 |
| ① |
|
| ② |
|
| ③ |
|
实验室中用右图装置制取氯气:
试完成下列问题:
(1)该反应是氧化还原反应吗?___________,如果是氧化还原反应,请指出___________是氧化剂,___________是还原剂,写出该反应的离子方程式______________________________。
(2)集气瓶A中盛装的是饱和食盐水(注:氯气在饱和食盐水中溶解度很小,而氯化氢在饱和食盐水中的溶解度则很大),其作用是______________________________________________。
(3)氯气溶于水显酸性,且氯气有毒,并有强烈的刺激性,若吸入大量氯气,可中毒死亡,所以氯气尾气直接排入大气中,会污染环境。实验室中可采用____________________溶液来吸收有毒的氯气。
实验室制取SO2的反应原理为:Na2SO3+H2SO4(较浓)====Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率。
(1)这些装置的连接顺序(按气体左右的方向)是_________→_________→_________→
_________→_________→_________→_________→(填各接口的编号)。
(2)实验时甲仪器的作用与原理是
_________________________________________________。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是____________。
(4)Ⅳ处观察到的现象是_____________________________________________。
(5)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重m g,则本实验中SO2的转化率为___________。
实验室用下图所示实验装置制取纯净的CuCl2,完成下列问题:
(1)实验室里,实验前检查整套装置的气密性方法是:_____________________________。
(2)装置A中发生的化学反应方程式为_____________________________。
(3)装置B的广口瓶盛__________,其作用是_____________________________________。装置C的广口瓶盛__________,其作用是___________________。装置E的烧杯中盛有,其作用是_____________________________。
(4)待充分反应后,装置D的玻璃管中剩余物呈_________色,冷却后,将制得的产物配成饱和溶液,溶液呈_________色。
含苯酚的工业废水处理的流程如下图:
(1)上述流程中,设备Ⅰ中进行的是操作__________(填写操作名称)。实验室里这一步操作可以用__________进行(填写仪器名称)。
(2)由设备Ⅱ进入设备Ⅲ的物质A是__________,由设备Ⅲ进入设备Ⅳ的物质B是__________。
(3)在设备Ⅲ中发生反应的化学方程式为______________________________。
(4)在设备Ⅳ中,物质B的水溶液和CaO反应后,产物是NaOH、H2O和_________。通过__________操作(填写操作名称),可以使产物相互分离。
(5)在上图中,能循环使用的物质是C6H6、CaO、__________、__________。
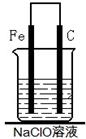
某学校探究性学习小组对消毒液次氯酸钠(NaClO)的制备与性质等进行了探究。
甲同学:为制备消毒液,探究并制作了一种家用环保型消毒液(NaClO溶液)发生器,设计了如图所示的装置,用石墨作电极电解饱和氯化钠溶液。
请完成下列问题:若通电时,为使生成的Cl2被完全吸收,制得有较强杀菌能力的消毒液,则电源的a电极名称为 极(填“正”、“负”、“阴”或“阳”);装置溶液中反应生成NaClO的离子方程式为: 。
乙同学:从某超市中查询到某品牌消毒液包装说明的部分内容,摘录如下:
主要有效成份为次氯酸钠,有效氯含量8000-10000mg/L。可用于各类家居用品、餐具、棉织衣物等的消毒,对彩色织物可能有褪色作用。切勿用于丝绸、毛、尼龙、皮革、油漆表面,勿用于铝、铜、碳钢制品。本品须密封,置阴凉暗处保存。
请完成以下实验探究过程:
I.阅读材料,根据学过的知识判断问题
(1)室温条件下,该消毒液(NaClO)的不显中性的原因是(用离子方程式表示)
_____________________。
(2)该消毒液还具有的化学性质是_________(填序号)。
A.强氧化性 B.强还原性 C.不稳定性 D.漂白性 E.弱酸性
(3)从该消毒液的保存要求分析,导致其失效的主要原因是(用化学方程式表示)
_ 。
II.确定要研究的问题
该消毒液对碳钢制品的腐蚀原理。
III.设计方案,实施探究
(1)用烧杯取少量样品,将一颗光亮的普通碳钢钉放入烧杯,浸泡一段时间。
预期的实验现象是_________________________________。
(2)为了进一步探究铁钉在该漂白剂(NaClO)溶液中的腐蚀原理,丁同学设计了如下图实验装置,写出碳(C)极上发生的电极反应式: 。