某混合碱是①Na2CO3和NaHCO3或② Na2CO3和 NaOH。用“双指示剂法”对样品的组分和总碱量 [n (Na2O) ] 进行测定。实验方案:称取 0.2960g 样品配成 500mL 溶液,取25.00mL置于250mL 锥形瓶中,加适量蒸馆水和几滴酚酞,用0.0100 mol•L-1的盐酸标准溶液将混合碱滴定成NaHCO3,然后再用溴甲酚绿——二甲基黄为指示剂进行滴定,将NaHCO3完全中和。
(1)某同学平行滴定了三次,每次滴定从 "0" 点开始读数,其中第 I 次滴定的第一个终点的液面如右图所示,请读出实验数据,填入下列表格中
| 序号 |
第一滴定终点的读数(V1/mL) |
第二滴定终点的读数(V2/mL) |
| I |
? |
26.85 |
| II |
10.02 |
25.02 |
| III |
9.98 |
24.98 |
(2)该混合碱样品的组成为 ,理由 。
(3)将混合碱滴定成NaHCO3的过程中,为了结果更加准确,应始终逐滴滴加,这样操作的原因是 。
(4)上述碱样中总碱量[n (Na2O) ]是多少?写出计算过程
。
(5)如果本实验只测定样品的总碱量,实验方案应该怎样设计:
。
(Ⅰ)常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
| 实验编号 |
HA的物质的量 浓度(mol·L-1) |
NaOH的物质的量 浓度(mol·L-1) |
混合后 溶液的pH |
| 甲 |
0.1 |
0.1 |
pH=a |
| 乙 |
0.12 |
0.1 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还是弱酸? ▲ 。
(2)乙组混合溶液中离子浓度c(A—)和c(Na+)的大小关系是 ▲ 。
A.前者大 B. 后者大 C. 二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是 ▲ 。
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
c(Na+)—c(A-)= ▲ mol·L-1
(Ⅱ)某二元酸(化学式用H2B表示)在水中的电离方程式是:
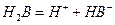

回答下列问题:
(5)在0.1mol/L的Na2B溶液中,下列粒子浓度关系式正确的是 ▲ 。
A.c( B2—)+c(HB—)=0.1mol/L B.c( B2—)+ c(HB—)+c(H2B)=0.1mol/L
C c(OH—)=c(H+)+ c(HB—) D.c(Na+)+c(OH)=c(H+)+ c(HB—)
已知H2B在水溶液中存在以下电离:

 一级电离:H2B H++HB-,二级电离:HB- H++B2-
一级电离:H2B H++HB-,二级电离:HB- H++B2-
请回答以下问题:
(1)NaHB溶液 (填“呈酸性”、“呈碱性”或“无法确定”),原因是
。
(2)若0.1mol·L-1的H2B溶液在某温度下的pH=3,c(B2-)=1×10-6mol·L-1,则H2B的一级电离的电离度为 。
(3)某温度下,在0.1mol·L-1的NaHB溶液中,以下关系一定不正确的是 ( )
A.c(H+)·c(OH-)=1×10-14
B.pH>1
C.c(OH-)=2c(H2B)+c(HB-)+c(H+)
D.c(Na+)=0.1mol·L-1≥c(B2-)
|
 (4)某温度下,FeB(s) Fe2+(aq)+B2-(aq)
(4)某温度下,FeB(s) Fe2+(aq)+B2-(aq)
A、B、C、 D、 E五种溶液分别是NaOH、NH3·H2O、CH3COOH、HCl、NH4HSO4中的一种。常温下进行下列实验:
①将1L pH=3的A溶液分别与0.001mol·L-1 xL B溶液、0.001mol·L-1 yL D溶液充分反应至中性,x、y大小关系为:y<x;
②浓度均为0.1mol·L-1A和E溶液,pH:A<E;
③浓度均为0.1mol·L-1C与D溶液等体积混合,溶液呈酸性。回答下列问题:
(1)E是 溶液。
(2) 用水稀释0.1 mol·L-1B时,溶液中随着水量的增加而减小的是 (填写序号) 。
①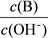 ②
②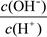 ③c(H+)
③c(H+)
④ OH-的物质的量 ⑤ c(H+)和c(OH-)的乘积
(3)OH-浓度相同的等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,下列说法正确的是 (填写序号) 。
①反应所需要的时间E>A ②开始反应时的速率A>E
③参加反应的锌粉物质的量A=E ④反应过程的平均速率 E>A
⑤A溶液里有锌粉剩余 ⑥E溶液里有锌粉剩余
(4)室温下,将pH=1的A溶液aL与pH=12的D溶液bL混合,所得混合液的pH=3,设混合溶液体积变化忽略不计,则a:b= 。
(5)0.1 mol·L-1C溶液中各种离子浓度由大到小的顺序是:
。