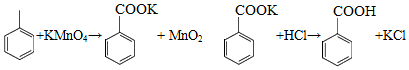
苯甲酸可用作食品防腐剂。实验室可通过甲苯氧化制苯甲酸,其反应原理简示如下:
名称 |
相对分子质量 |
熔点/℃ |
沸点/℃ |
密度/(g•mL﹣1) |
溶解性 |
甲苯 |
92 |
﹣95 |
110.6 |
0.867 |
不溶于水,易溶于乙醇 |
苯甲酸 |
122 |
122.4(100℃左右开始升华) |
248 |
﹣﹣ |
微溶于冷水,易溶于乙醇、热水 |
实验步骤:
(1)在装有温度计、冷凝管和搅拌器的三颈烧瓶中加入1.5mL甲苯、100mL水和4.8g (约0.03mol)高锰酸钾,慢慢开启搅拌器,并加热回流至回流液不再出现油珠。
(2)停止加热,继续搅拌,冷却片刻后,从冷凝管上口慢慢加入适量饱和亚硫酸氢钠溶液,并将反应混合物趁热过滤,用少量热水洗涤滤渣。合并滤液和洗涤液,于冰水浴中冷却,然后用浓盐酸酸化至苯甲酸析出完全。将析出的苯甲酸过滤,用少量冷水洗涤,放在沸水浴上干燥。称量,粗产品为1.0g。
(3)纯度测定:称取0.122g粗产品,配成乙醇溶液,于100mL容量瓶中定容。每次移取25.00mL溶液,用0.01000mol•L﹣1的KOH标准溶液滴定,三次滴定平均消耗21.50mL的KOH标准溶液。
回答下列问题:
(1)根据上述实验药品的用量,三颈烧瓶的最适宜规格为 (填标号)。
A.100mL B.250mL C.500mL D.1000mL
(2)在反应装置中应选用 冷凝管(填“直形”或“球形”),当回流液不再出现油珠即可判断反应已完成,其判断理由是 。
(3)加入适量饱和亚硫酸氢钠溶液的目的是 ;该步骤亦可用草酸在酸性条件下处理,请用反应的离子方程式表达其原理 。
(4)“用少量热水洗涤滤渣”一步中滤渣的主要成分是 。
(5)干燥苯甲酸晶体时,若温度过高,可能出现的结果是 。
(6)本实验制备的苯甲酸的纯度为 ; 据此估算本实验中苯甲酸的产率最接近于 (填标号)。
A.70% B.60% C.50% D.40%
(7)若要得到纯度更高的苯甲酸,可通过在水中 的方法提纯。
羟基乙酸钠易溶于热水,微溶于冷水,不溶于醇、醚等有机溶剂。制备少量羟基乙酸钠的反应为ClCH2COOH+2NaOH→HOCH2COONa+NaCl+H2O△H<0
实验步骤如下:
步骤1:在如图所示装置的反应瓶中,加入40g氯乙酸、50mL水,搅拌。逐步加入40% NaOH溶液,在95℃继续搅拌反应2小时,反应过程中控制pH约为9。
步骤2:蒸出部分水至液面有薄膜,加少量热水,趁热过滤。滤液冷却至15℃,过滤得粗产品。
步骤3:粗产品溶解于适量热水中,加活性炭脱色,分离掉活性炭。
步骤4:将去除活性炭后的溶液加到适量乙醇中,冷却至15℃以下,结晶、过滤、干燥,得羟基乙酸钠。
(1)步骤1中,如图所示的装置中仪器A的名称是 ;逐步加入NaOH溶液的目的是 。
(2)步骤2中,蒸馏烧瓶中加入沸石或碎瓷片的目的是 。
(3)步骤3中,粗产品溶解于过量水会导致产率 ( 填“增大”或“减小”);去除活性炭的操作名称是 。
(4)步骤4中,将去除活性炭后的溶液加到适量乙醇中的目的是 。
