在KClO3+6HCl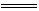 KCl+3Cl2↑+3H2O的反应中,被氧化的氯原子与被还原的氯原子的原子个数比是( )
KCl+3Cl2↑+3H2O的反应中,被氧化的氯原子与被还原的氯原子的原子个数比是( )
| A.1:6 | B.1:5 | C.6:1 | D.5:1 |
已知下列物质都能氧化H2S,它们氧化H2S时自身分别发生下列变化:Fe3+→Fe2+,Cr2O72-→2Cr3+,Br2→2Br-,HNO3→NO。如要氧化等物质的量的H2S气体得到S单质,需要上述离子或物质的物质的量最小的是
| A.Fe3+ | B.Br2 | C.Cr2O72— | D.HNO3 |
在实验室中,常用KMnO4代替MnO2与浓盐酸反应制取氯气,其反应的化学方程式为2KMnO4+16HCl(浓)= 2MnCl2+5Cl2↑+2KCl+8H2O,下列叙述中正确的是
| A.反应中KMnO4被氧化 |
| B.氧化剂与还原剂的物质的量之比为5﹕1 |
| C.每生成1 mol Cl2时,反应中转移的电子为2 mol |
| D.每消耗16 mol HCl时,其中做氧化剂的HCl是10 mol |
下列氧化还原反应中,1molH2O得到1mol电子的是
| A.2F2+2H2O=4HF+O2 | B.2Na2O2+2H2O=4NaOH+O2↑ |
| C.2Na+2H2O=2NaOH+H2↑ | D.3NO2+H2O=2HNO3+NO |
有Fe2+﹑NO3-﹑Fe3+、NH4+﹑H2O和H+六种微粒,分别属于一个氧化还原反应中的反应物和生成物,下列叙述错误的是
| A.氧化剂与还原剂的物质的量之比为8∶1 |
| B.还原产物为NH4+ |
| C.若有1 mol NO3-参加还原反应,则转移8mol e- |
| D.若把该反应设计为原电池,则负极反应为Fe2+—e-= Fe3+ |
全世界每年铜的产量为8×106t,工业上由辉铜矿(主要成分是Cu2S,其中铜元素为+1价)生产铜的主要反应为:Cu2S+O2
| A.该反应中Cu2S只是还原剂 |
| B.每生产1molCu需转移2mol电子 |
| C.该反应中Cu2S既是氧化剂又是还原剂 |
| D.若用该反应生产铜,全世界每年产生的SO2的体积(标准状况)约为1.4×106L |
制备粗硅的反应为:SiO2+2C Si+2CO↑,其中氧化剂与还原剂的物质的量之比为
Si+2CO↑,其中氧化剂与还原剂的物质的量之比为
| A.1 : 3 | B.3 : 1 | C.1 : 2 | D.2 : 1 |
以下为在浓盐酸中H3AsO3与SnCl2反应的离子方程式,关于该反应的说法正确的组合是:( )
a SnCl2+b Cl-+c H3AsO3+d H+=e As+f SnCl62-+g M
①氧化剂是H3AsO3; ②M为OH-;
③每生成7.5gAs,还原剂失去的电子为0.3 mol; ④ SnCl62-是氧化产物。
| A.①③④ | B.①②④ | C.①②③④ | D.只有①③ |
在KI和KIO3混合溶液中通入H2S发生反应后,只生成碘、硫酸钾和水,在此反应中被氧化的碘元素与被还原的碘元素的物质的量之比为( )
| A.5:1 | B.6:1 | C.1:1 | D.1:5 |
用水热法制备Fe3O4纳米颗粒的总反应如下:
3Fe2++ 2S2O32-+O2+4OH-= Fe3O4 + S4O62-+2H2O。下列说法正确的是( )
| A.在反应中1molO2氧化了3mol Fe2+ |
| B.还原剂是Fe2+,氧化剂是S2O32-和O2 |
| C.每生成1mol Fe3O4,转移3mol电子 |
| D.当转移1mol电子时,消耗56gS2O32- |
向含0.78molFeCl2溶液中通入0.09molCl2,再加入100mL1mol/L的X2O72-酸性溶液,使溶液中的Fe2+恰好全部氧化,则产物中X的化合价为
| A.+1 | B.+2 | C.+3 | D.+5 |
某氧化剂中,起氧化作用的是X2O72-离子,在溶液中0.2mol该离子恰好能使0.6mol的SO32-离子完全氧化,则X2O72-离子还原后X的化合价为( )
| A.+1 | B.+2 | C.+3 | D.+4 |
据悉,第16届中国广州亚运会在上使用的发令枪所用的“火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白色烟雾。撞击时发生反应的化学方程式为:KClO3+ P-- P2O5+ KCl(未配平),则下列有关叙述错误的是( )
| A.上述反应是放热反应 |
| B.产生白色烟雾的原因是生成的P2O5白色固体小颗粒(烟)吸水性很强,吸收空气中的水分,生成磷酸小液滴(雾) |
| C.该反应氧化剂与还原剂物质的量之比为6:5 |
| D.上述反应中消耗3molP时,转移电子的物质的量为15mol |