向由Cu、Cu2O和CuO组成的混合物中,加入10 mL 6 mol·L-1的稀硝酸溶液,恰好使混合物完全溶解,同时收集到标准状况下NO 224 mL。请回答以下问题:
(1)写出Cu2O与稀硝酸反应的离子方程式 。
(2)产物中硝酸铜的物质的量为 。
(3)若原混合物中有0.01molCu,则其中Cu2O的物质的量为 ,CuO的物质的量为 。
2012年3月22日是第二十届“世界水日”,保护水资源,从我做起!
(1)C1O2和C12(还原产物都为Cl一)是生活中常用的消毒剂。当消耗等物质的量的两种物质时,C1O2的消毒效率是C12的 倍。
(2)自来水厂常用高铁酸钠(Na2FeO4,强氧化剂)改善水质。简述高铁酸钠用于杀菌消毒同时又起到净水作用的原理: 。
(3)某无色废水中可能含有Fe3+、A13+、Mg2+、Na+、NO3-、CO32一、SO42-离子中的几种,为分析其成分,分别取废水样品100 mL,进行了三组实验,其操作和有关现象如图所示:
请根据上图回答下列问题:
①实验中需配制1.0 mol/L的NaOH溶液80 ml,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器为 。
②实验③中沉淀量由A→B过程中所发生反应的离子方程式为 。
③试确定NO3-是否存在? (填“存在”“不存在”或“不确定”),若存在,试计算c(NO3-) (若不存在,此问不必作答)。
实验室将NaClO3和Na2SO3按物质的量为2:1放入烧杯中,同时滴入适量H2SO4,并用水浴加热,产生棕黄色的气体X,反应后测得NaClO3和Na2SO3恰好完全反应,则X的化学式为( )
| A.Cl2 | B.Cl2O | C.ClO2 | D.Cl2O3 |
已知:还原性强弱:I― >Fe2+。往100 mL碘化亚铁溶液中缓慢通入3.36 L(标准状况)氯气,反应完成后溶液中有1/2的Fe2+被氧化成Fe3+。则原碘化亚铁溶液的物质的量浓度为
| A.1.1mol·L-1 | B.1.5mol·L-1 | C.1.2mol·L-1 | D.1.0mol·L-1 |
32g铜与150mL一定浓度的硝酸恰好完全反应,产生的NO2和NO混合气体在标准状况下的体积为11.2L。则该硝酸的物质的量浓度为
| A.5mol/L | B.15mol/L | C.10mol/L | D.8mol/L |
铁与HNO3作用时,还原产物除与HNO3浓度有关外,还与温度有关。已知铁
与冷的稀HNO3反应时,主要还原产物为NO气体;与热的稀HN03反应时,主要还原产物
为N2O气体;当HNO3更稀时,其重要还原产物是NH4+。现有铁与稀 HNO3的作用,请分析
下图,回答有关问题。
假设曲线的各段内只有一种还原产物。
(1)0点到a点的还原产物是 ________ __。
(2)a点到b点的还原产物是__ __,其原因是 。
(3)试完成b点到c点的反应方程式:
口Fe+口HNO3——口Fe( NO3)3+口[ ]+口H20。
(4)反应过程中,到达 ________ 点时,HN03已完全反应。
(5)已知达到d点时反应结束,此时溶液中的主要阳离子是 。
(6)c点和d点参加反应的铁的物质的量之比是 ___________。
人体血液里Ca2+的浓度一般采用mg/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(Ca2C2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用酸性KMnO4溶液定量反应即可测定血样样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。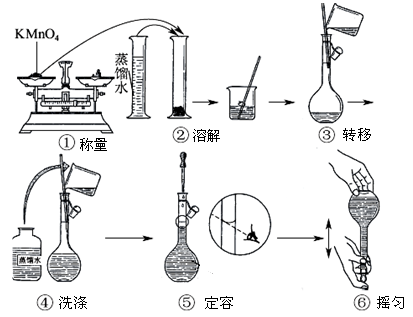
【实验探究一】配制酸性KMnO4标准溶液。如上图所示是配制100mL 酸性KMnO4标准溶液的过程示意图。
(1)请你观察图示判断其中不正确的操作有____________(填序号);
(2)其中确定100mL溶液体积的容器是____________(填名称);
(3)如果按照图示的操作所配制溶液进行实验,在其他操作均正确的情况下,所得KMnO4溶液浓度将_________(填“偏大”或“偏小”)。
【实验探究二】测定血液样品中Ca2+的浓度,抽取血样20.00mL,经过上述处理后得到草酸,再用0.020mol/L 酸性KMnO4溶液与之反应,使草酸转化成CO2逸出,这时共消耗12.00mL KMnO4溶液。
(4)已知草酸跟KMnO4反应的离子方程式为:2MnO4-+5H2C2O4+6H+═2Mnx++10CO2↑+8H2O则式中的x=_________
(5)经过计算,血液样品中Ca2+的浓度为___________ mg/cm3。
取铜镁合金完全溶于浓硝酸中,反应过程中硝酸被还原只产生0.896L NO2气体和0.672 L N2O4的气体(气体体积都已折算到标准状况),在反应后的溶液中加足量的氢氧化钠溶液,生成沉淀质量为3.7g。则合金中铜与镁的物质的量之比等于
| A.1 :1 | B.2 :1 | C.3 :2 | D.2 :3 |
研究性学习小组进行了一系列化学实验后,发现高锰酸钾分解后的含锰元素的化合物都能和浓盐酸反应制得氯气,且锰化合物的还原产物都是MnCl2.他们将6.32gKMnO4粉末加热一段时间,也不知道高锰酸钾是否完全分解,收集到0.112L气体后便停止加热了,冷却后放入足量的浓盐酸再加热,又收集到气体体积是(上述气体体积都折合成标准状况)
| A.0.448L | B.2.240L | C.2.016L | D.无法确定 |
将0.15molFe3O4完全溶解在足量稀硫酸中,然后加入K2Cr2O7溶液250mL,恰好使溶液中Fe2+全部氧化成Fe3+,Cr2O72-全部转化成Cr3+,则K2Cr2O7溶液的物质的量浓度是
| A.0.05mol/L | B.0.1mol/L | C.0.2mol/L | D.0.3mol/L |
Cl2是一种重要的化工原料,结合氯气的相关知识解决下列问题。
(1)运输氯气的钢瓶上应贴的标签为_____________。
| A.腐蚀品 | B.爆炸品 | C.有毒品 | D.易燃品 |
(2)工业上将氯气通入石灰乳制取漂白粉,写出该反应的化学方程式 。
(3)漂白粉的有效成分是(填化学式)_____________。
(4)实验室可以用KMnO4与浓盐酸在常温下制备Cl2。高锰酸钾溶液常用于物质的定性检验与定量分析。某化学兴趣小组在实验室里欲用KMnO4固体来配制500 mL 0.1mol/L的KMnO4溶液。
①需用的仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、 。
②下列操作会导致实验结果偏小的是 (填字母)。
a.转移时没有洗涤烧杯、玻璃棒
b.容量瓶内壁附有水珠而未干燥处理
c.颠倒摇匀后发现凹液面低于刻度线又加水补上
d.加水定容时俯视刻度线
③用配好的该浓度的KMnO4溶液与300mL 0.2mol/L的KI溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的体积为 mL。(已知MnO4-在此条件被还原为Mn2+)
(5)氯水中含有多种成分,因而具有很多性质,根据氯水分别与如图四种物质发生的反应填空(a、b、c、d重合部分代表物质间反应,且氯水足量,已知:Cl2 + 2Br-=2Cl-+ Br2)。
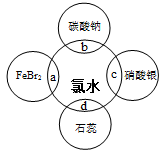
①能证明氯水具有漂白性的是__________(填“a”、“b”、“c”或“d”),现象是 。
②a中发生反应的离子方程式是 。
aL某浓度的SnC12溶液与过量FeC13溶液充分混合后,再加入 L 0.2000 mol·L-1 K2Cr2O7溶液,恰好完全反应,则SnC12的浓度为
L 0.2000 mol·L-1 K2Cr2O7溶液,恰好完全反应,则SnC12的浓度为
(提示:①2Fe3++Sn2+=2Fe2++ Sn4+;②6Fe2++Cr2O +14H+=6Fe3++2Cr3++7H2O)
+14H+=6Fe3++2Cr3++7H2O)
| A.0.3000 mol·L-1 | B.1.2000 mol·L-1 |
| C.0.0333 mol·L-1 | D.0.1333 mol·L-1 |
下图所示为含Cr化合物在一定条件下的转化: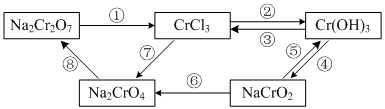
(1)①~⑧所示转化中,需要加入氧化剂才能实现的是_______(填写序号)。
(2)在上述转化中,既能与强酸反应又能与强碱反应的两性物质是______(填化学式)。
(3)转化①可通过下列反应实现:
①完成并配平的化学方程式:
__Na2Cr2O7+__KI+__H2SO4——__Cr2(SO4)3+__Na2SO4+__K2SO4+__I2+__H2O
②用单线桥表示电子转移的方向和数目
③反应中每转移0.4mol电子,生成I2的物质的量为______mol。