将32.64g铜与200mL一定浓度的硝酸反应,铜完全溶解产生的混合气体在标准状况下的体积为11.2L。请回答:
(1)NO的体积为 L,NO2的体积为 L(各保留二位有效数字)。
(2)待产生的气体全部释放后,向溶液加入VmL amol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为 mol/L。
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水 g。
某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。
(1)请完成SO2与过量NaOH溶液反应的化学方程式: ________________.
(2)反应Cl2+Na2SO3+2 NaOH===2NaCl+Na2SO4+H2O中的氧化产物为______________.
(3)请完成MnO2和浓盐酸制备Cl2的离子方程式: _______ _________.
(4)如果14.2g氯气与足量的氢气反应,然后生成的气体用500mL某浓度的NaOH溶液恰好反应,则此NaOH的浓度为 。(假设溶液体积不变)
离子M2O7X-与S2-能在酸性溶液中发生如下反应:M2O7X- +3S2- +14H+==2M3+ +3S? +7H2O,
则M2O7X-中M的化合价为 ( )
| A.+4 | B.+5 | C.+6 | D.+7 |
雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1) As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。写出此反应的化学方程式 。
(2)上述反应中的氧化剂是 ,氧化产物是  。
。
(3) As2S3和HNO3有如下反应:As2S3+ 10HNO3=2H3AsO4+ 3S+10NO2↑+ 2H2O
若生成1mol H3AsO4,则反应中转移电子的物质的量为 。
(4)在3Cu + 8HNO3= 3Cu(NO3)2 + 2NO↑+4H2O的反应中,有6.4g铜被氧化,参加反应的HNO3的质量是____________g,被还原的HNO3的质量是__________g。
(5)在一定条件下,P bO2与Cr3+反应,产物是Cr2O72-和Pb2+,则生成1mol C
bO2与Cr3+反应,产物是Cr2O72-和Pb2+,则生成1mol C r2O72-
r2O72-
反应所需PbO2的物质的量为__________ ____。
____。
已知:2Fe3++2I-=2Fe2++I2,向1L含有Fe2+、I━、Br━的溶液中通入适量氯气,溶液中各种离子的物质的量变化如下图所示。横、纵坐标的单位均为mol。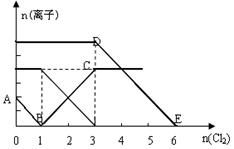
有关说法不正确的是( )
| A.线段BC代表Fe3+ 物质的量的变化情况 |
| B.原混合溶液中c(FeBr2)= 6 mol/L |
| C.当通入Cl22mol时,溶液中已发生的反应可表示为:2Fe2++2I━+2Cl2=2Fe3++I2+4Cl━ |
| D.原溶液中n (Fe2+): n (I━): n(Br━)=2:1:3 |
FeS与足量的稀硝酸反应,生成Fe(NO3)3、S、NO和H2O。若反应中有0.3mol的电子转移,则参加反应的硝酸中未被还原的硝酸的 物质的量为( )
物质的量为( )
| A.0.9mol | B.0.45mol | C.0.3mol | D.0.1mol |
11P+ 15CuSO4+ 24H2O = 5Cu3P+ 6H3PO4 + 15H2SO4反应中,被氧化的P原子与被还原的P原子个数比是 ( )
| A.6:5 | B.5:6 | C.11:5 | D.11:6 |
11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4反应中,被氧化的P原子与被还原的P原子个数比是
| A.6:5 | B.5:6 | C.11:5 | D.11:6 |
(10分) 水热法制备Fe3O4纳米颗粒的反应是 3Fe2++2S2O32-+O2+xOH-===Fe3O4+S4O62-+2 H
H 2O,回答下列问题:
2O,回答下列问题:
( 1 ) . X== .
(2).该反应中的还原剂是 。
(3). 1 m ol Fe2+被氧化时,被Fe2+还原的O2
ol Fe2+被氧化时,被Fe2+还原的O2 的物质的量
的物质的量 为 .
为 .
(4). 该反应中,每生成1 mol Fe3O4,该反应 转移的电子总的物质的量为 。
转移的电子总的物质的量为 。
( 5 ). Na 2S2O3与稀硫酸反应生成一种沉淀和一种有刺激性气味的气体,写出该反应的离子方程式:
2S2O3与稀硫酸反应生成一种沉淀和一种有刺激性气味的气体,写出该反应的离子方程式:
。
氯酸是一种强酸,氯酸的浓度超过40%,就会迅速分解,反应的化学方程式为:
8HClO3 → 3O2↑+ 2Cl2↑+ 4HClO4 + 2H2O。根据题意完成第27~30题:
27.在上述变化过程中,发生还原反应的过程是:___________→___________(填化学式)。
28.该反应的氧化产物是______________(填化学式);所得混合气体的平均式量为_______。
29.已知测定锰的一种方法是:锰离子转化为高锰酸根离子,反应体系中有H+、Mn2+、H2O、IO3—、MnO4—、IO4—离子,有关离子反应方程式为:
。
30.在锰离子转化为高锰酸根离子的反应中,如果把反应后的溶液稀释到1升,测得溶液的pH = 2,则在反应中转移电子的物质的量为 mol。
若(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,则该反应中化合价发生变化和未发生变化的N原子数之比为 ( )
| A.1∶4 | B.1∶2 | C.2∶1 | D.4∶1 |
a mol FeS与b mol FeO投入到VLc mol/L稀硝酸中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为
①(a+b)×63g ②(a+b)×189g ③(a+b)mol ④(cV-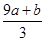 )mol
)mol
| A.①④ | B.②④ | C.②③ | D.①③ |
三氟化氮(NF3)是微电子工业中一种优良的等离子蚀刻气体。它无色、无臭,在潮湿的空气中能发生下列反应:3NF3+5H2O=2NO+HNO3+9HF,下列有关说法正确的是
| A.反应中NF3是氧化剂,H2O是还原剂 |
| B.反应中被氧化与被还原的原子物质的量之比为2∶1 |
| C.若反应中生成0.2mol HNO3,则反应共转移0.2mol e- |
| D.NF3在潮湿空气中泄漏会产生白雾、红棕色气体等现象 |
依据离子反应:1N2H5++4Fe3+===4Fe2++aY+……(a是配平后Y的系数),在水溶液中N2H5+将Fe3+还原为Fe2+,则N2H5+被氧化后的产物Y可能是 ( )
| A.N2 | B.H2 | C.NH3 | D.NO |