在一块大理石(主要成分是CaCO3)上,先后滴加①1mol/LHCl溶液和②0.1mol/LHCl溶液反应快的是滴加了____ _________的(填序号,下同),先后滴加同浓度的③热盐酸和④冷盐酸,反应快的是滴加 的,用⑤大理石块和⑥大理石粉分别跟同浓度的盐酸起反应,反应快的是用了 的。
现有XYZ三种元素。
(1)X的单质可以在Z的单质中燃烧生成XZ,火焰为苍白色。
(2)XZ极易溶于水,其水溶液可使蓝色石蕊试纸变红。
(3)X、Y、Z的单质在常温下为气体。
(4)两分子X的单质可以和Y单质化合生成两分子X2Y(常温下为液体)。
(5)Z的单质溶于X2Y中得到溶液具有漂白性,推断
①XYZ各为何元素(写元素符号)?X__________ Y__________ Z__________
②XZ和X2Y各是什么物质(写化学式)? XZ__________ X2Y__________
根据事实,写出下列有关化学反应的符号表达式及其所属的基本反应类型
(1)点燃镁条做信号弹 属于 反应
(2)铁丝燃烧 属于 反应
(3)向过氧化氢中加入二氧化锰 属于 反应
(4)蜂窝煤中硫燃烧 属于 反应
(5)加热氯酸钾 属于 反应
钠原子的质量数为23,中子数为12,那么它的核外电子数是__________,质子数是__________。
按要求书写下列方程式并填写反应类型(12分):
实验室制取氧气(任写一种) 反应类型
实验室制取二氧化碳 反应类型
氢气还原氧化铜 反应类型
铁在氧气中燃烧 反应类型
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,生成4mol z时放出热量Q KJ, 它们的物质的量随时间的变化如表所示。
| t/min |
X/mol |
Y/mol |
Z/mol |
| 0 |
1.00 |
1.00 |
0.00 |
| 1 |
0.90 |
0.80 |
0.20 |
| 3 |
0.75 |
0.50 |
0.50 |
| 5 |
0.65 |
0.30 |
0.70 |
| 9 |
0.55 |
0.10 |
0.90 |
| 10 |
0.55 |
0.10 |
0.90 |
| 14 |
0.55 |
0.10 |
0.90 |
(1)根据上表中数据,在答卷该题相应位置上画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
(2) 写出体系中发生反应的热化学方程式 ______;
(3) 列式计算该反应在0-3min时间内产物Z的平均反应速率:
(4) 该反应达到平衡时反应物X的转化率 等于______________________;
等于______________________;
(5) 改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线1、2、3(如下图所示)则曲线1、2、3所对应的实验条件改变分别是:1 _____2_____3_____的曲线:
包括3小题,(共10分)
(1)1mol H2SO4中约含有 个H2SO4, mol H , mol O
(2)9.03×1023个CO2的物质的量是 mol,在标准状况下的体积 L,质量是是 克。
(3)在100mL2mol/LH2SO4溶液中,H2SO4的质量是 克。H+的物质的量浓度为 。
(4)质量分数为36.5%、密度为1.18g/cm3的浓盐酸中HCl的物质的量浓度为 。
按要求进行书写:
(1)氯化铝溶液与足量的氨水反应的离子方程式:
(2)用氯化铁溶液蚀刻印刷铜电路板反应的离子方程式:
(3)解释装氢氧化钠溶液的试剂瓶不能用磨口玻璃塞原因的化学方程式:
(4)等物质的量的二氧化硫与氯 气同时通入水中反应的化学方程式:
气同时通入水中反应的化学方程式:
2014年全运会在辽宁举办,其开幕式就是一场焰火盛宴。
(1)焰火利用了部分金属元素特征的 反应,该反应属于 (填“物理”或“化学”)变化。
(2)如图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素组成,每种化合物仅含两种元素。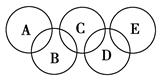
图中A是沼气的主要成分,B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E分子结构的球棍模型为 ,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3∶4,电子总数之比为3∶2。根据以上信息回答下列问题:
,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3∶4,电子总数之比为3∶2。根据以上信息回答下列问题:
①B的水溶液呈弱酸性,其主要的电离方程式可表示为 ,D的化学式是 。
②A、B、E中均含有的一种元素符号为 。
③C与纯碱反应的化学方程式为 。
④液态B与液态E反应可生成一种单质和一种常见液体,1 mol B参加反应放出热量Q kJ,其反应的热化学方程式为 。
甲是一种盐,由A、B、C、D、E五种元素组成,其中四种是短周期元素。甲溶于水后可电离出三种离子,其中含有由A、B形成的五核10电子阳离子。A元素原子核内质子数比E的少1,D、E处于同主族。用甲进行如下实验:
①取少量甲的晶体溶于蒸馏水配成溶液;
②取少量甲溶液于试管中滴入KSCN溶液,无现象,再滴入氯水,溶液呈红色;
③取少量甲溶液于试管中加入适量NaOH溶液,加热;
④取少量甲溶液于试管中,向其中加入稀盐酸,无明显现象,再加入BaCl2溶液,出现白色沉淀。
回答下列问题:
(1)C的元素符号是 ,D的原子结构示意图 。
(2)用离子方程式表示实验②中现象的原因:
(3)实验③中出现的现象是 。
(4)经测定甲晶体的摩尔质量为392 g/mol,其中阳离子与阴离子物质的量之比为3:2,则甲晶体的化学式为 。
用数轴表示化学知识,并按某种共性对化学物质进行分类,有简明易记的效果。例如,根据碳素钢的含碳量,将其分为低碳钢、中碳钢、高碳钢,利用数轴分类法可将其表示为:
根据这一分类方法请回答:
(1)将pH与溶液酸碱性的关系粗略地表示在如下数轴上:
(2)某化学兴趣小组欲研究H2SO4、KCl、NaCl、Na2CO3、Na2SO3、NaOH六种物质的性质,对于如何研究,他们设计了两种研究方案:
方案Ⅰ:将它们按照酸、碱、盐分类,然后分别溶于水得到溶液,进行实验。
方法Ⅱ:将它们按照钠盐、钾盐和其他化合物分类,然后分别溶于水得到溶液,进行实验。
①根据方案Ⅰ进行分类时,经实验测得KCl、NaCl溶液的pH等于7;H2SO4溶液的pH小于7;Na2SO3、Na2CO3、NaOH溶液的pH大于7。由此有的同学按分类法思想把Na2SO3、Na2CO3与NaOH都划分为碱类是否合理?为什么?_____________________________。
②在方案Ⅰ中,某同学发现盐类物质中的KCl、NaCl在与其他物质混合时现象相同,无法区分,请设计一种简单的方法区分这两种物质_____________________________。
③在方案Ⅱ中,三种钠盐用其他物质中的________可加以区分,有关反应的化学方程式分别为_____________________________________________________________________。
④该兴趣小组中的一位同学认为,还可以根据是否含有钠元素将上述六种物质分为Na2SO3、Na2CO3、NaCl、NaOH和H2SO4、KCl两类。在用H2SO4鉴别四种含钠元素的物质时,Na2SO3和Na2CO3很容易得到了区分,但鉴别NaCl和NaOH时却陷入了困境,请设计一个实验来解决这一难题:__________________________________________。
现有一种溶液,其中可能含有Mg2+、Al3+、Fe2+、Cu2+、NH4+。当加入一种淡黄色固体并加热溶解时,有刺激性气味的气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系如图所示。试回答下列问题:
(1)最终的白色沉淀的成分是(填化学式) ,你的理由是 
(2)试确定该溶液中可能含有以上离子中的哪些离子并计算其相应的物质的量,完成下表(可以不填满)
| 可能含有的离子 (填离子符号) |
|
|
|
|
|
| 相应的物质的量 |
|
|
|
|
|
(4)图中a点的值为
(5)图中b点的气体组成成分是(填化学式) ,其物质的量之比是
合成氨是人类科学技术上的一项重大突破,是化学和技术对社会发展与进步的巨大贡献之一。在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒。除去CO的化学反应方程式(HAc表示醋酸):
Cu(NH3)2Ac + CO + NH3 = Cu(NH3)3(CO)Ac
请回答下列问题:
(1)C、N、O的第一电离能由大到小的顺序为 ▲ 。
(2)写出基态Cu+的核外电子排布式 ▲ 。
(3)配合物Cu(NH3)3(CO)Ac中心原子的配位数为 ▲ 。
(4)写出与CO互为等电子体的离子 ▲ 。(任写一个)
(5)在一定条件下NH3与CO2能合成化肥尿素[CO(NH2)2],尿素中 C原子轨道的杂化类型分别为 ▲ ;1 mol尿素分子中,σ键的数目为 ▲ 。
(6)铜金合金形成的晶胞如上图所示,其中Cu、Au原子个数比为 ▲ 。