在标准状况下①6.72L CH4 ②3.0 1×1023个HCl分子③13.6g H2S ④0.2mol NH3, 下列对这四种气体的关系从大到小表达正确的是 ( )
1×1023个HCl分子③13.6g H2S ④0.2mol NH3, 下列对这四种气体的关系从大到小表达正确的是 ( )
a.体积②>③>①>④ b.密度②>③>④>①
c.质量②>③>①>④ d.氢原子个数①>③>④>②
A.abc  |
B.bcd | C.abcd | D.acd |
下列有关溶液性质的叙述,正确的是
| A.室温时饱和的二氧化碳水溶液,冷却到00C时,会放出CO2气体。 |
| B.200C,100g水可溶解34.2gKCl,此时KCl的饱和溶液的质量分数为34.2% |
| C.强电解质在水中溶解度一定大于弱电解质 |
| D.相同温度下,把水面上的空气换成相同压强的纯氧,100g水中溶入氧气的质量增加 |
物质发生化学变化时,下列量在反应前后肯定不发生变化的是
①电子总数 ②原子总数 ③分子总数 ④物质种类 ⑤物质的总质量 ⑥物质的总能量
| A.①②⑤ | B.①②③⑤ | C.②⑤⑥ . | D.①④⑤⑥ |
下列化学用语或叙述正确的是( )
| A.-OH与OH-均是10电子粒子 | B.H2O2的电子式:H+[:O: O:]2-H+ |
| C.在分子晶体中不一定有化学键 | D.在晶体中,有阳离子就一定有阴离子 |
化学知识中有很多的“相等”,下列说法中不正确的是( )
| A.参加化学反应的物质的总质量等于反应后生成的物质的总质量 |
| B.化合物中元素化合价的正价总数与负价总数的数值相等 |
| C.溶液加水稀释前后溶质的质量相等 |
| D.在原子中原子核内的质子数和中子数都相等 |
下列有关化学用语使用正确的是
A.磷(P)基态原子最外层轨道表示式: |
B.钢铁发生吸氧腐蚀的正极反应式- |
C.葡萄糖的实验式: |
D.氰基细电子式: |
判断下列有关化学基本概念的依据正确的是 ( )
| A.溶液与胶体:本质不同的原因是能否发生丁达尔效应 |
| B.氧化还原反应:有元素化合价升降 |
| C.强弱电解质:溶液的导电能力大小 |
| D.共价化合物:是否含有共价键 |
下列各项叙述正确的是 ( )
| A.由同种元素组成的物质肯定属于纯净物 |
| B.具有相同质子数的粒子都属于同种元素 |
| C.一种元素可有多种离子,但只有一种电中性的原子 |
| D.有新单质生成的化学反应,不一定都属于氧化还原反应 |
向等质量的a、b两份锌粉中,分别加入过量的稀H2SO4,同时向a中加入少量的CuSO4溶液。下图表示产生H2的体积(V)与时间(t)的关系,其中正确的是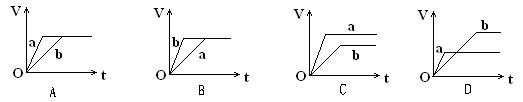
如图所示,2个X分子反应生成1个Y分子和3个Z分子,下列判断不正确的是
| A.根据质量守恒定律可推知,1个Z分子中含有2个A原子 |
| B.该反应属于分解反应 |
| C.该反应属于氧化还原反应 |
| D.X、Y、Z三种物质均属于非电解质 |
运用元素周期律分析下面的推断,其中错误的是
| A.铍(Be)是一种金属,它的氧化物的水化物可能具有两性 |
| B.砹是一种有色固体,HAt很不稳定,AgAt是有色难溶于水的固体 |
| C.硫酸锶(SrSO4)是难溶于水和盐酸的的白色固体 |
| D.硒化氢(H2Se)是无色、有毒、比H2S稳定的气体 |
下列说法正确的是
| A.盐的组成中一定含有金属元素 |
| B.由同种元素组成的纯净物一定是单质 |
| C.同一化合物里同种元素的化合价一定相同 |
| D.金属与酸反应一定产生氢气 |
以下数据对应的条件不充分的是
| A.25℃时醋酸的电离度:0.1% |
| B.20℃、101.3KPa时HCl在水中的溶解度为 1:442 |
| C.99℃时水的离子积:1×10-12 |
| D.标准状况时氧气的密度:1.429 g/L |
石墨由多“层”构成,质地柔软,但分离成一“层”后即成为“石墨烯”,硬度超过了金刚石,导电能力也大大超过了一般的导体,这再次验证了
| A.量变引起质变的规律 | B.能量守恒与转换的规律 |
| C.勒夏特列原理 | D.阿伏加德罗定律 |