已知污染性气体氮氧化物能用碱液除去,反应如下:
2NO2 + 2NaOH=NaNO2 +NaNO3+ H2O NO + NO2 + 2NaOH=2NaNO2 + H2O
根据硝酸尾气处理的反应原理,下列气体中不能被过量NaOH溶液完全吸收的是( )
| A.1mol O2和4mol NO2 | B.1mol O2和4mol NO |
| C.1mol NO和5mol NO2 | D.4mol NO和1mol NO2 |
已知在T°C和一定压强下,往容积可变的密闭容器中充入2molSO2和1molO2,此时容器容积为VL,保持恒温恒压,使反应:2SO2(g)+O2(g)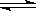 2SO3(g)在5min末达到平衡,测得SO3的体积分数为0.4;试回答下列问题:(1)平衡混合气体中SO2的体积分数为 ,平衡过程中O2的转化率为 ;(2)另选一容积固定不变的容器,仍控制温度为T°C,充入2molSO2和1molO2使反应,达到平衡时SO3的体积分数仍为0.4,则密闭容器的体积为: L。
2SO3(g)在5min末达到平衡,测得SO3的体积分数为0.4;试回答下列问题:(1)平衡混合气体中SO2的体积分数为 ,平衡过程中O2的转化率为 ;(2)另选一容积固定不变的容器,仍控制温度为T°C,充入2molSO2和1molO2使反应,达到平衡时SO3的体积分数仍为0.4,则密闭容器的体积为: L。
下列化学用语表达正确的是
| A.丙烯的结构简式:CH3CHCH2 | B.异戊烷分子的球棍模型: |
C.次氯酸的 结构式为:H—Cl—O 结构式为:H—Cl—O |
D.Mg原子结构示意图: |
设NA为阿伏加德罗常数,下列叙述中正确的是:
| A.常温下11.2L的甲烷气体含有甲烷分子数为0.5NA个 |
| B.标准状况下,11.2L四氯化碳所含分子数为0.5 NA |
| C.14g乙烯和丙烯的混合物中总原子数为3NA个 |
| D.1L、0.1mol/LH2SO3溶液中含SO32-离子数为0.1NA个 |
NA表示阿伏加德罗常数的值,下列说法中正确的是
| A.标准状况下,11.2 L NO和11.2 L O2混合后气体的分子总数为0.75NA |
| B.室温下,42.0g乙烯和丙烯的混合气体中含有的碳原子数为3NA |
| C.常温下,pH=2的稀盐酸中所含有的H+离子数大于0.01 NA |
| D.1mol CH3+(碳正离子)中含有电子数为10NA |
将NO2、NH3、O2的混和气体22.4L通过稀硫酸后,溶液的质量增加26.7克,气体体积缩小为4.48L(气体体积均在标准状况下测定),剩余气体能使带火星的木条复燃,则混和气体的平均分子量是( )
| A.28.1 | B.30.2 | C.33.1 | D.34.0 |