下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是( )
A.NH4Cl NH3+HCl NH3+HCl |
B.2Na2O2+2CO2=2Na2CO3+O2 |
| C.NH3+CO2+H2O=NH4HCO3 | D.2NaOH+Cl2=NaCl+NaClO+H2O |
下列各组物质的变化过程,所克服的微粒间作用力,属于同种类型的是
| A.I2单质的升华和HCl的分解 |
| B.SiO2和NaCl的熔化 |
| C.CCl4汽化和干冰的升华 |
| D.Al2O3和冰的熔化 |
下列物质中,既含有离子键,又含有共价键的是
| A.H2O | B.MgCl2 | C.NaOH | D.CH3COOH |
物质的下列变化,化学键不被破坏的是
| A.干冰气化 | B.HCl溶解于水 |
| C.食盐融化 | D.NH4Cl受热变成气体 |
下列微粒中含有孤对电子的是
| A.SO3 | B.CH4 | C.NH4+ | D.H3O+ |
下列共价键的键能最大的是
| A.HF | B.HCl | C.HBr | D.HI |
下列物质中,中心原子的杂化类型为sp3杂化的是
| A.BeCl2 | B.NH3 | C.BF3 | D.C2H4 |
下列有关晶体的说法正确的是
| A.分子晶体中一定不含离子键 | B.分子晶体中一定含有共价键 |
| C.离子晶体中一定只含离子键 | D.离子晶体的熔点一定比共价化合物高 |
下列含有非极性键的离子晶体是 ( )
①醋酸钠固体 ②氢氧化钾固体 ③过氧化钠固体
④金刚石 ⑤固态乙醇 ⑥氯化钙固体
| A.③⑥ | B.①③ | C.③④⑤ | D.②⑥ |
以共价单键相连的非金属单质中,1个原子与相邻原子成键的数目为(8-N)个,N为该非金属元素的族序数,这一现象被化学家称为8-N规则。某非金属单质的结构如图所示,构成该单质的元素位于( )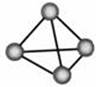
| A.第ⅢA族 | B.第ⅣA族 |
| C.第ⅤA族 | D.第ⅥA族 |
现有如下各种说法,正确的是 ( )
①在水中氢、氧原子间均以化学键相结合
②分子中键能越大,键长越长,则分子越稳定
③干冰受热变为气体和碘升华所克服的粒子间作用力属于同种类型
④H2S和CS2分子都是含有极性键的极性分子
⑤乙烯分子中C-C之间未参加杂化的2p轨道形成π键
⑥CH4、NH3、CCl4分子的空间构型是正四面体形
| A.①③⑤ | B.②⑥ | C.③⑤ | D.③④⑤ |
共价键、离子键、金属键、范德华力和氢键都是微观粒子之间的不同作用力,下列物质:①Na2O2;②冰;③金刚石;④碘单质;⑤CaCl2;⑥白磷,其中只含有两种作用力的组合是 ( )
| A.①④⑥ | B.①③⑥ | C.②④⑥ | D.①②③⑥ |