现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:
(1)写出下列物质的化学式
A 、 B 、 C 、乙
(2)写出下列反应化学方程式:
反应①
反应③
(3)写出下列反应离子方程式:
反应④
反应⑥
A、B、C、D为四种单质,常温时,A、B是气体,C、D是固体。E、F、G、H、I为五种化合物,F不溶水,E为气体且极易溶水成为无色溶液,G溶于水得黄棕色溶液。这九种物质间反应的转化关系如图所示

(1)写出四种单质的化学式
A________ B_______ C______ D______
(2)写出H+B→G的离子方程式 ;
(3)写出G+I→H+D+E的化学方程式 ;
(4)某工厂用B制漂白粉。
①写出制漂白粉的化学方程式 。
②为测定该工厂制得的漂白粉中有效成分的含量,某该小组进行了如下实验:称取漂白粉3.0g,研磨后溶解,配置成250mL溶液,取出25.00mL加入到锥形瓶中,再加入过量的KI溶液和过量的硫酸(此时发生的离子方程式为: ),静置。待完全反应后,用0.2mol·L-1的Na2S2O3溶液做标准溶液滴定反应生成的碘,已知反应式为:2Na2S2O3+I2 =Na2S4O6+2NaI,共用去Na2S2O3溶液20.00mL。则该漂白粉中有效成分的质量分数为 保留到小数点后两位)。
已知物质A~I之间的转化关系符合下图所示。其中A、C、F、G、I为常见固体且其焰色反应均为黄色;A为海水中主要溶质,B为常温下常见液体;E为黄绿色气体,H能使澄清石灰水变浑浊,其余物质通常状况下均为气体。


试回答下列问题:
(1)写出下列物质的化学式:A E F H
(2)完成反应②离子方程式:
反应③化学方程式:
已知下列各物质都是由短周期元素组成,它们之间的关系如下图所示:

常温下,A、F为金属单质,F既能与L溶液反应,又能与N溶液反应。C、H、M为气体单质,其中H呈黄绿色,A、B、I、K、L、R焰色反应均为黄色。请回答:
(1)P的结构式为 ,B的电子式为 。
(2)R的水溶液呈碱性的原因可用离子方程式表示为 。
(3)还有一种物质能与B反应生成C,写出这个反应的化学方程式 。
(4)还有一种单质能与J反应生成C,写出这个反应的化学方程式 。
(5)某气体Q具有漂白作用,将Q与H等物质的量通入水中所得溶液没有漂白作用,写出该过程中发生反应的离子方程式______________。
已知:(1)A为正盐。(2)常温、常压下,B、C、D、E、G、H、I均为气体,其中D、G、H为单质,H为黄绿色气体,I通常为红棕色气体。(3)F在常温下是一种无色液体。(4)C、J的水溶液是一种酸。图中部分反应条件及产物已略去。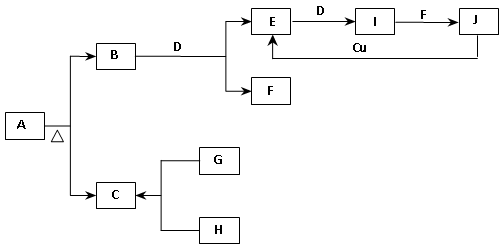
(1)写出A的化学式:A 。
(2)写出下列反应的化学方程式:
①B + D → E + F : ;
②J + Cu → E: ;
③H和石灰乳的反应: 。
(3)在I和F的反应中,氧化剂和还原剂的质量比为: 。
已知A为一种盐,C、D、F、N、O为无色气体,E常温常压下为无色无味的液体,N、
H、L为高中常见的单质,I为常见无氧强酸,M的焰色反应为紫色,反应①常用于气体F的检验。
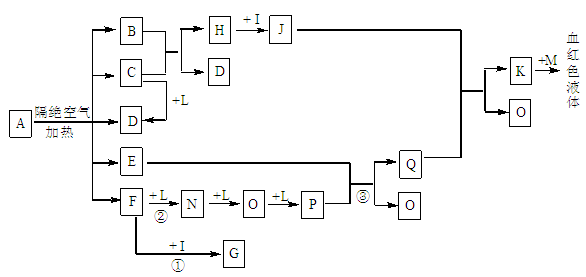
(1)写出D的电子式为_______________;
(2)写出反应②的化学方程式: ;反应③中氧化剂和还原剂的物质的量之比为_________________;
(3)将等体积、等浓度的G和F的溶液混合,溶液显碱性,则溶液中离子浓度从大到小的顺序为 ;
(4)检验J中阳离子的实验方法为 ;
(5)已知B中氧元素的质量分数为22.2﹪,且A分解产生的各物质的物质的量之比为n(B):n(C):
n(D):n(E):n(F)=1:2:2:1:2,则A的化学式为__________________________。
字母A—F代表六种不同物质,它们之间可发生如下图的转化(部分反应中生成物没有全部列出)。其中D是一种强酸;E是一种常见金属,有“国防金属”的美誉,可在CO2中燃烧。分析图示回答下列问题:
(1)A可以是 或 ;
(2)E在CO2中燃烧的化学方程式为 ;
(3)D与F反应的化学方程式为 ,该反应中D表现了 性;
(4)50mL 14 mol·L-1物质D的溶液中加入足量的铜,充分反应后共收集到气体2.24L(标准状况下),则被还原的D的物质的量为 mol,参加反应的铜的质量为 g。
下列框图涉及到的物质所含元素中,除一种元素外,其余均为1~18号元素。
已知:A、F为无色气体单质,B为具有刺激性气味的气体,C为黑色氧化物,E为红色金属单质(部分反应的产物未列出)。请回答下列问题:
(1)D的化学式为 ;E原子外围电子排布式为 _______
(2)A与B生成D的反应在工业上是生产 的反应原理之一。
(3)E与G的稀溶液反应的离子方程式为 .
(4)B和C反应的化学方程式为 。
(5)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式
某强酸性溶液X,可能含有Al3+、Ba2+、NH4+ 、Fe2+、Fe3+、CO32-、SO42-、SiO32-、NO3-中的一种或几种离子,取该溶液进行实验,其现象及转化如下图。反应过程中有一种气体是红棕色。请回答下列问题:

(1)由强酸性条件即可判断溶液X中一定不存在的离子有 。
(2)溶液X中,关于NO3-的判断一定正确的是_ ___。
a.一定有 b.一定没有 c.可能有
(3)产生气体A的离子方程式为 。
(4)转化⑥发生反应的现象为 。
(5)转化④中产生H的离子方程式为 。
(6)若转化③中,D、H2O、O2三种物质恰好发生化合反应生成E,则反应中D与O2的物质的量之比为____。
(7)对不能确定是否存在的离子,可以另取X溶液,加入下列溶液中的一种,根据现象即可判断,该试剂最好是 。
①NaOH溶液,②KSCN溶液,③石蕊试剂,④pH试纸,⑤KMnO4溶液,⑥氯水和KSCN的混合溶液
现有金属单质A、B、C、D和气体甲、乙、丙及物质E、F、G、H、I,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
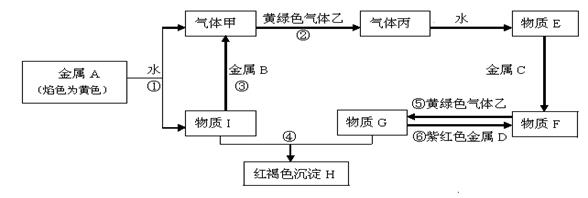
请根据以上信息回答下列问题:
(1)写出下列物质的化学式: B ;F ;H ;
(2)写出反应①的离子方程式:
写出反应⑥的离子方程式: ;
(3)气体乙与SO2气体都具有漂白性,将等体积的气体乙和SO2通入到水中,得到的溶液是否具有漂白性?_______________(填“是”或“否”).反应的化学方程式:
A~H是纯净物或溶液中的溶质,其中A是日常生活中应用最广、用量最大的金属单质。它们之间有如下关系:(部分产物和反应条件略)

根据上述信息,回答下列问题:
(1)写出下列物质的化学式B ,E 。
(2)H和 SO2生成强酸F,此反应中氧化剂是 。
(3)写出①的离子方程式: 。
(4)写出②的化学方程式: 。
(5)C溶液中滴入NaOH溶液有何现象 。
所发生反应的化学方程式为___________________,____________________。
A、B、C、D、E五种可溶性化合物,分别由阳离子Fe3+、 Ba2+、Al3+、Na+、Ag+和阴离子NO3-、OH-、SO42-、Cl-、CO32-中的各一种组成(离子不重复)。现做如下实验:
①A和E的溶液显碱性,0.1mol/L A溶液的pH小于13;
②在B的溶液中逐滴加入氨水有白色沉淀生成,继续加氨水至过量,沉淀消失;
③在C的溶液中加入铁粉,溶液的质量增加;
④在D的溶液中加入过量的Ba(OH)2溶液,没有沉淀。
(1)根据以上事实推断A-E的化学式:
A 、B 、C 、E
(2)写出①A溶液呈碱性和③的离子方程式:
①
③ _
A、B、D、R、Q五种短周期主族元素,其原子序数依次增大,其中A原子核内无中子,B与D同周期,R与Q同周期,A与R同主族,D与Q同主族,D元素的原子最外层电子数是次外层电子数的三倍,B元素的最高正价和最低负价代数和为2。请用对应的化学用语回答下列问题:
(1)Q元素位于元素周期表中第______周期_____族。
(2)D、R、Q三种元素形成的简单离子的半径由大到小的顺序是________(用离子符号表示)。
(3)由A、B两种元素以原子个数比为5:1形成的离子化合物X,X的电子式为_______。
(4)由A、B元素形成的A2B4可以与O2、KOH溶液形成原电池,该原电池负极的电极反应式为____。
(5)由A、D、R、Q四种元素形成的化合物Y(RAQD3)(已知A2QD3的Ka1=1.2×10-2、Ka2=6.3×10-8),则Y溶液中各离子浓度由大到小的顺序为_______________;室温下,向Y溶液中加入一定量的NaOH,使溶液中c(AQD3-)=c(QD32-),则此时溶液呈______(填“酸性”、“碱性”或“中性”)
(6)Fe与D元素可形成Fe2D3、Fe3D4等化合物。向5.2g Fe2D3、Fe3D4、Cu的混合中加入0.5mol/L的硫酸溶液140mL时,固体恰好完全溶解,所得溶液中不含Fe3+。若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为______g。
Ⅰ.某废水中可能含有下列离子中的若干种:Fe3+、Al3+、Fe2+、Cu2+、Cl-、CO32-、NO3-、SO42-、SiO32-。现进行如下实验:
Ⅰ.取少量溶液,加入KSCN溶液,无明显变化
Ⅱ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色
Ⅲ.向Ⅱ中所得溶液中加入BaCl2溶液,有白色沉淀生成
Ⅳ.向Ⅱ中所得溶液中加入过量浓氨水,仅有红褪色沉淀生成,过滤,在所得溶液中加入盐酸至酸性时,再加入氢氧化钠溶液,有蓝色沉淀生成
请回答下列问题:
(1)该废水一定含有的离子是_____________;
(2)实验Ⅱ中加入盐酸生成无色气体的离子方程式是________________;
(3)过滤除去Ⅳ中的蓝色沉淀,调整溶液的pH为10.7左右时,加入铝粉,反应产生氨气和氮气的体积比为1:4,其离子方程式为Al+NO3-+OH- AlO2-+NH3+N2+H2O(未配平)。若除去0.2molNO3-,消耗铝____________g。
AlO2-+NH3+N2+H2O(未配平)。若除去0.2molNO3-,消耗铝____________g。
Ⅱ.某混合液中,可能大量含有的离子如下表:
| 阳离子 |
H+、K+、Al3+、NH4+、Mg2+ |
| 阴离子 |
Cl-、Br-、OH-、CO32-、AlO2- |
为探究其成分,某同学将Na2O2逐渐加入到上述混合溶液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系分别如图所示: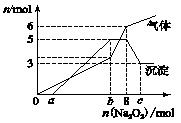
(1)该溶液中一定含有的阳离子是_____________,其对应物质的量浓度之比为____________,溶液中一定不存在的阴离子是____________________。
(2)请写出沉淀减少的离子方程式________________________。