下图中A~J均代表无机物或其水溶液,其中B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料。

根据图示回答问题:
(1)按要求写出下列化学用语:若B原子中子数比质子数多1,则B的原子符号为 ;C的电子式为 ,若D最外层只有两个电子,则D的原子结构示意图 ;
(2)写出反应①的化学方程式是 ;写出反应②的化学方程式并标出电子转移的方向和数目__________________
(3)J与稀硝酸反应的离子方程式是 ;用排水法收集满该反应的还原产物后,将试管倒扣在水槽中并通入O2使试管刚好全部充满水,假设液体不外溢,则所得溶液的物质的量浓度为 。
如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,已知:

①反应C+G  B+H能放出大量的热,G是红综色固体粉末;
B+H能放出大量的热,G是红综色固体粉末;
②I是一种常见的温室气体,它和E可以发生反应:2E+I  2F+D,F中的E元素的质量分数为60%.
2F+D,F中的E元素的质量分数为60%.
回答问题:
(1)①中反应的化学方程式为______________________________;
(2)1.6g G 溶于盐酸,得到的溶液与铜粉完全反应,至少需要铜粉__________克;
(3)C与过量NaOH溶液反应的离子方程式为________________________________,
反应后的溶液与过量的化合物I反应的离子方程式为_______________________;
(4)E与I反应的化学方程式为______________________________;
(5)写出H物质在工业上的一种用途___________________;
(6)将一定量的B完全溶于过量盐酸中,然后通入0.005mol Cl2,再加入0.01mol重铬酸钾晶体(K2Cr2O7),恰好使溶液中B2+全部转化为B3+,铬元素本身被还原为+3价铬离子。通过计算确定原B的物质的量为______。
A.0.01mol B.0.03mol C.0.04mol D.0.07mol
下列关系图中,A是一种正盐,D的相对分子质量比C的相对分子质量大16,Z是常见的一种无色液体,E是酸。当X无论是强酸还是强碱时,都有如下转化关系:当X是强酸时,A、B、C、D、E均含有同一元素:当X是强碱时,A、B、C、D、E均含有另一种元素.回答下列问题:

(1)A是_ ,Y是 ,Z是 .
(2)当X是强酸时,E是 ,写出B生成C的化学方程式
(3)当X是强碱时,E是 ,写出B生成C的化学方程式
现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、红褐色沉淀H,已知黄绿色气体乙为Cl2,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出),请根据以上信息回答下列问题:

(1)写出下列物质的化学式
B________ C_______G 丙
(2)一小块A放在坩埚里,加热,写出该反应的化学方程式: ;
B的氧化物与D反应的离子方程式 ;反应⑥的离子方程式 ;
无机非金属材料的主角I的单质也能与物质D反应有甲生成,试着写出该反应的化学方程式 ;
反应④中氧化剂与还原剂物质的量之比为 。
(3)物质G的溶液中加入NH4SCN溶液,现象______________________,写出该反应的离子方程式 。
Ⅰ、以下是依据一定的分类标准,对某些物质与水的反应情况进行分类的分类图。请根据你所学的知识按要求填空:

(1)上述第一级分类标准(分成A、B组的依据)是:__________________
(2)D组物质包括_________________________________(填化学式)。
(3)C组物质中某一物质在常温时能与冷水反应,其化学方程式为_____ ____。
(4)D组中某一物质与E组中某一物质在水中反应生成两种强酸,写出该反应的离子方程式:_______________________________________________________。
Ⅱ、下图中每一方格表示有关的一种反应物或生成物。A、C为无色气体。

(1)物质M可以是________或________,C是________,F是________。
(2)反应①的化学方程式______________________________。
(3)反应②的离子方程式_______________________________。
(4)F→G的化学方程式_________________________________。
A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互的转化关系如下图所示。请回答下列问题: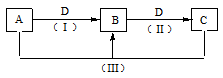
(1)若A、B、C的溶液均显碱性,C为焙制糕点的发酵粉的主要成分之一.
①A中所含化学键类型为___________,D的电子式为___________;
②25℃时,0.1mol•L-1 B、C溶液,pH较大的是___________溶液(填溶质的化学式),写出B溶液中显电中性的原因___________,已知,B溶液里的pH=10,则其水电离出来的H+的浓度为________________。
(2)向反应体系中同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
I.CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H1=-802.6kJ/mol
II.CH4(g)+O2(g)═CO2(g)+2H2(g)△H2=-322.0kJ/mol
III.CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=+206.2kJ/mol
Ⅳ.CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H4=+165.0kJ/mol
请回答下列问题:
①CH4的燃烧热△H________△H1.(填“>”、“<”或“=”);
②在反应初始阶段,反应II的反应速率大于反应III的反应速率.比较反应II的活化能EII和反应III的活化能EIII的大小:EII________EIII(填“>”、“<”或“=”)。
置换反应的通式可用右图表示,单质甲、乙和化合物A、B为中学常见物质,请回答下列问题:

(1)若单质甲是生活中用途最广泛的金属,单质乙是最轻的气体,则甲是 。
(2)若化合物A常温下呈液态,化合物B的焰色反应呈黄色,则该反应的离子反应方程式为 。
(3)工业上利用置换反应原理制备一种半导体材料,写出该反应的化学方程式 。
(4)若气体单质乙能在空气中燃烧,化合物B为黑色磁性晶体,写出该反应的化学方程式 。
A、B、C为中学常见单质,其中一种为金属;通常情况下A为固体、B为黄绿色气体、C为无色气体。D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种无氧强酸溶液,E为黑色固体,H在常温下为液体。它们之间的转化如图所示(某些反应条件和部分反应产物已略去)。

(1)写出下列物质的化学式:D X 。
(2)在反应①~⑦中,不属于氧化还原反应的是 (填编号)。
(3)反应⑥的离子方程式为: 。
(4)往G溶液中加入NaOH溶液观察到的现象是 。
(5)反应⑦的化学方程式为 ;该反应中每消耗0.3mol的A,可转移电子 mol。
(6)除去D溶液中混有的少量G的方法是: 。
已知有如右图所示转化关系(反应条件略)。
已知;①X、Y、Z、W均为氧化物。常温下,X是红棕色气体;Y能使澄清石灰水变浑浊但不能使品红溶液褪色。②相对分子质量:甲<乙。③将甲的浓溶液露置在空气中一段时间,质量减小浓度降低;将乙的浓溶液露置在空气中一段时间,质量增加浓度降低。请完成下列空白:
(1)Z是(写化学式):______________。
(2)将乙的浓溶液露置在空气中一段时间,质量增加浓度降低,表明乙的浓溶液具有__________性。利用这种性质可以进行__________项(填字母)实验操作。
| A.钝化铁片 | B.检验Ba2+ | C.干燥氨气 | D.干燥氯气 |
(3)在X与Z的反应中,被氧化的X与被还原的X的物质的量之比是________________。
(4)W可用于工业制溴过程中吸收潮湿空气中的Br2,写出该反应的离子方程式:______________。该反应很好地解决了环保问题,但给工业生产带来了_______________的问题。
(5)写出M与甲的浓溶液在加热条件下反应的化学方程式:______________。
在下列各变化中,E为无色无味的液体(常温下),F为淡黄色粉末,G为常见的无色气体(反应条件均已省略)。回答下列问题:

(1) 写出反应②的化学反应方程式 ,在该反应中,每生成2.24LG(标准状况),该反应转移电子的物质的量是 。
(2)若反应①在溶液中进行,A、C、D均含氯元素,且A中氯元素的化合价介于C和D之间。则反应①的化学方程式是 。
(3)若反应①在溶液中进行,A是一种强酸,B是一种含两种金属元素的盐,当A过量时,C及D均易溶于水。则A过量时反应①的离子反应方程式是 。
化合物A为一种常见金属元素与一种常见非金属元素组成的化合物,阳离子与阴离子的个数比为2:3。K为常见固态非金属单质,J为常见气态单质。其余为化合物,其中I、F在常温下为液态,C、D为刺激性气体,H无色无味气体,B为白色胶状沉淀,L为氯碱工业中的常见产品。F的浓溶液与K加热可生成D和H。(部分生成物未标出)

(1)写出下列物质的化学式:E J
(2)写出D通入足量稀Ba(NO3)2溶液反应的化学方程式:_______________________
(3)银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故,根据电化学原理可进行如下处理,在Al制容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色会褪去,写出该反应的离子方程式_____________
(4)A电池性能优越,A-AgO电池可用作水下动力电源,其原理如图所示.该电池反应的化学方程式为:2A+3AgO+2NaOH=2NaAO2+3Ag+H2O,下列说法正确的是

A.该隔膜是阳离子交换膜
B.当电极上析出1.08 g Ag时,电路中转移的电子为0.01 mol
C.A电极的反应式为:A-3e-+4OH-=AO2-+2H2O
D.正极的电极反应式为:O2+2H2O+4e-=4OH-
下图中A~J均为中学化学中常见的物质.它们之间有如下转化关系。其中,A、D为金属单质,A元素是地壳中含量最多的金属元素(反应过程中生成的水及其它产物己略去)
请回答以下问题:
(1)B是______,H是________(填化学式)。
(2)写出A直接转化为F的离子反应方程式:_____________。
(3)写出E与过量氨水反应的离子反应方程式:_______________。
(4)H在空气中转化为I 的化学反应方程式:__________________。
(5)写出A与B高温下发生的化学反应方程式__________________。
(6)用一个离子方程式表示E转化为F___________________。
室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适反应条件下,它们可以按下图进行反应。又知E溶液是无色的,请回答:
(1)A是________、C是________(请填化学式)。
(2)反应①的化学方程式为:______________________________。
(3)反应④的化学方程式为:______________________________。
(4)实验室制备气体B的化学方程式为:_____________________。
Ⅰ、A、B、C、D是原子序数均小于20的四种元素。A与B同主族,且能形成BA2、BA3两种化合物。B、C、D所形成的简单离子电子层结构相同,且B、C、D离子半径依次减小。请回答下列问题:
①D元素在元素周期表中的位置是______________。
②A与D所形成的化合物的电子式为___________________。
③将C单质的水溶液滴加到B与D所形成化合物的水溶液中,其反应的化学方程式为_______________ 。
Ⅱ、由短周期元素组成的中学常见的含钠元素的物质A、B、C、D,存在如图转化关系(部分生成物和反应条件已略去)。

(1)若A为金属钠, A与水反应的离子方程式为 。
(2)若A为过氧化钠, A与水反应的化学方程式为 。
(3)A不论是Na还是Na2O2,依据转化关系判断物质D是 ,
(4)向30ml某浓度的B溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同。若向M中逐滴加入0.1mol/L盐酸,产生的气体V(CO2)与加入盐酸的体积V(HCl)的关系有下列图示两种情况(不计CO2的溶解),则曲线B表明M中的溶质为 ;原NaOH溶液的物质的量浓度为 ;由曲线A、B可知,两次实验通入的CO2的体积比为 。

(5)请你设计一实验证明Na2CO3溶液碱性比NaHCO3溶液的碱性强:__________________。
X、Y、Z、W四种化合物均由元素周期表前18号元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去)。

请回答:
(1)W的化学式是 。
(2)X与Y在溶液中反应的离子方程式是 。
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用下图装置(夹持固定装置已略去)进行实验,装置III中生成白色沉淀,装置V中可收集到一种无色气体。

①装置I中反应的化学方程式是 。装置II中物质的化学式是 。
②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的位置V中气体,该化合物的化学式是 ,所需仪器装置是 (从上图选择必要装置,填写编号)。