(6分)有一包白色固体,可能含有CaCO3、Na2SO4、KNO3、CuSO4、BaCl2五种物质中的一种或几种。现进行如下实验:
⑴取少量固体粉末加到足量水中,得到白色沉淀,上层为无色清液。
⑵继续往其中加入足量稀硝酸,白色沉淀完全消失,并有气泡产生。
⑶取少量(2)中的溶液滴加Ba(NO3)2溶液,有白色沉淀生成,再加入稀硝酸,沉淀不溶。
根据上述实验现象判断:该白色固体中一定含有 ,一定不含有 ,可能含有 。
X、Y、Z、W四种常见化合物,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去):
请回答:
⑴W的化学式是____________________。
⑵X与Y在溶液中反应的离子方程式是_______________________________。
⑶①将4.48 L(已折算为标准状况)W通入100 mL3 mol/L的Y的水溶液后,溶液中的溶质是_______________。
②自然界中存在X、Z和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100 mL溶液,测得溶液中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为 g。
⑷Ⅰ和Ⅱ中为X所含有的四种元素中的两种或三种组成的化合物,并利用下图装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置Ⅴ中可收集到一种无色助燃性气体。
①装置Ⅱ中物质的化学式是 。
②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的装置Ⅴ中气体,该化合物的化学式是 ,所需仪器装置是 (从上图选择必要装置,填写编号)。
A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去)。
(1)若A是一种黄色单质固体,则B→C的化学方程式为 。
(2)若A是一种活泼金属,C是淡黄色固体,则C的名称为 ,C可用在矿山、坑道、潜水或宇宙飞船等缺氧的场合,将人们呼出的CO2再转换成O2,以供呼吸之用,请用化学方程式表示该反应原理 。
(3)若A为能使湿润的红色石蕊试纸变蓝的气体,C是红棕色气体,且B和C易在空气形成光化学烟雾。
①则A为 ,C为 ,(填写化学式)
实验室用熟石灰与氯化铵固体共热制取A,写出此化学方程式: 。
②写出C与水反应的化学方程式: 。
铝是一种重要金属,从铝土矿(主要成分为Al2O3,Fe2O3、SiO2等)中冶炼Al的工业生产流程如下图:
(1)沉淀B的化学式为 ,溶液A中含的阳离子主要有 。
(2)写出步骤II生成溶液C 的离子方程式 ,
步骤I、II、III都要用到的分离方法是 。
(3)生产过程中,除CaO可以循环使用外,还可以循环使用的物质有: (填化学式)。
(4)生产中曾用铝热反应焊接钢轨,则铝与氧化铁发生反应的化学方程式为:
(5)经分析,a吨铝土矿可以冶炼出b吨的铝(假设各生产环节中无损耗),则原铝土矿中Al2O3的纯度(质量分数) (用含a、b的最简式表示)。
请回答有关下列五种气体:H2、O2、NO、NH3、NO2的问 题。
I.(1)与制取O2的发生装置相同的是;______________只能用一种方法收集的是______________________________
(2)以上气体制备反应中,有一反应在原理上与其它反应都不能归为同一类型,请写出实验室制取该气体的方程式_________________________________
II. 用右图装置进行喷泉实验(图中夹持装置均已略去)。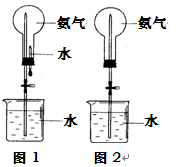
(1)若用图1装置进行喷泉实验,上部烧瓶已装满干燥的氨气,引发水上喷的操作是_____________________该实验的原理是______________________________________
(2)若用图2的装置,请举一例说明引发喷泉的方法___________________________
III:若用同一烧瓶分别充满如下气体:① HCl ② NH3③ NO2进行喷泉实验,实验后烧瓶内溶液液面的高度关系为____________________________ (用序号和“>,<或=”表示,下同),所得溶液物质的量浓度大小关系为 ____________________________ 。
现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示:
请回答下列问题:
⑴ 写出实验流程中下列物质的化学式试剂X:_______________ 沉淀A:_______________ 沉淀B:______________
⑵ 上述实验流程中加入过量的Na2CO3的目的是_______________________________。
⑶ 按此实验方案得到的溶液3中肯定含有_________________(填化学式)杂质。
(14分,每空2分)某试剂厂用银(含杂质铜)和硝酸(含Fe3+)反应制取硝酸银,步骤如下:
(1)工业上一般选用中等浓度的硝酸和银反应来制取硝酸银。请在下表空格处填空。
| |
优点 |
缺点 |
| 使用浓硝酸 |
反应速率快 |
酸耗较大,产生NOx的量较多 |
| 使用稀硝酸 |
|
|
(2)步骤B加热保温的作用是 :
a. 有利于加快反应速率
b.有利于未反应的硝酸挥发
c.有利于硝酸充分反应,降低溶液中H+的浓度
(3)步骤C是为了除去Fe3+、Cu2+等杂质,冲稀时产生沉淀的原因是 ;
(4)步骤C中加水的量应该适量,若加入过多的水,对后续步骤造成的不良影响是:
 ;
;
(5)步骤E进行的操作是  。
。
(6)制得的硝酸银中含有少量硝酸铜,通常除去硝酸铜的方法是在步骤E之前加适量新制的Ag2O,使Cu2+转化为Cu(OH)2沉淀,反应后过滤除去。该反 应的化学方程式为: 。
应的化学方程式为: 。
某金属冶炼厂的管道烟泥中含有炭黑及金属铜、锌、硫.综合实践活动小组的同学设计了从管道烟泥中回收金属铜并利用废气中的二氧化硫制备硫酸的实验方案,实验过程如图所示:
请回答:
(1)步骤①中,过滤操作使用了玻璃棒,其作用是 ;如何确定硫酸已经过量 。
(2)步骤④中,所加入的金属X与Zn的活动性顺序是Zn>X,金属X具有广泛用途,X是 ,有关反应的化学方程式 。
(3)除去不纯铜中的杂质金属X,可选用的试剂或用品有 (填标号)。
a.磁铁 b.稀盐酸 c.蒸馏水 d.氯化铜溶液.
(4)将分离出的SO2通过下列碘循环工艺过程既能制H2SO4,又能制取H2,其流程如下:
试写出反应器、膜反应器中的化学反应方程式 、 。
研究某一化学反应的实验装置右如下图所示:A~F属于下列物质中的六种物质:浓硫酸、浓盐酸、浓氨水、稀硫酸、稀盐酸、稀氯水、水、锌粒、铜片、食盐、高锰酸钾、氯化钙、氧化钙、四氧化三铁、氧化铁、氧化铜、氢气、二氧化碳、二氧化氮、一氧化碳、氯气、氯化氢、氨气、氮气、氧气。实验现象;①D物质由黑色变为红色②无水硫酸铜粉末放入无色透明的E中得到蓝色溶液③点燃的镁条伸入无色无味的F中镁条表面生成一种固体物质。将该物质放入水中,有气体放出,该气体具有刺激性气味。并能使润湿的红色石蕊试纸变蓝。通过分析回答:
(1)写出A~F的物质名称:A. ,B. , E. ,
(2)写出有关的化学方程式: C与D ;
F与Mg的反应产物与水 。
氟化钠是一种重要的氟盐,主要用作农业杀菌剂、杀虫剂、木材防腐剂。实验室可通过下图所示的流程以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氯化铵:
有关物质在水中溶解度分别为:
NH4Cl:10℃时33.3g、20℃时37.2g、30℃时41.4g;
NaF:20℃时4g;Na2SiF6:微溶。
请回答下列问题:
(1)指出副产品的用途: ;(任填一种即可)
(2)操作Ⅰ需要用到的玻璃仪器除玻璃棒、漏斗外,还有 ___ ;
(3)操作II的名称是 ;
(4)操作Ⅲ的具体过程是 、 ;
(5)上述流程中发生两步化学反应,请分别写出其化学方程式:
第一步: ;
第二步: ;
(6)流程中NH4HCO3必须过量,其原因是 ;
(8分)为了除去KCl溶液中少量的MgCl2、MgSO4,从稀盐酸、Na2CO3、Ba(NO3)2、K2CO3、Ba(OH)2溶液中,选择A、B、C 3种试剂,按图中的实验步骤进行操作:
加过量A后过滤加过量B后过滤
(1)3种试剂的化学式:A________,B________,C________。
(2)加过量A的原因是___________________________________, 有关反应的化学方程式为________________________________。
有关反应的化学方程式为________________________________。
(3)加过量B的有关反应的化学方程式为
_________________________________ _________________________________。
_________________________________。
苯佐卡因是临床常用的一种手术用药。以甲苯为起始原料的合成路线如图。
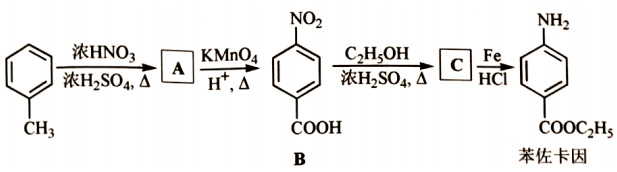
回答问题:
(1)甲苯分子内共面的H原子数最多为 个。
(2)A的名称是 。
(3)在A的同分异构体中,符合下列条件的是 ( 写出一种结构简式)。
①与A具有相同官能团
②属于芳香化合物
③核磁共振氢谱有5组峰
(4)B中官能团名称为 。
(5)B→C的反应方程式为 。
(6)反应过程中产出的铁泥属于危化品,处理方式为 ( 填编号)。
a.高温炉焚烧
b.填埋
c.交有资质单位处理
(7)设计以甲苯和丙三醇为原料合成3﹣苄氧基﹣1,2﹣丙二醇(  )的路线 (其他试剂任选)。
)的路线 (其他试剂任选)。
已知:在于HCl催化下丙酮与醇ROH反应生成缩酮。缩酮在碱性条件下稳定。在酸中水解为丙酮和醇ROH。
(8分)现有四瓶丢失标签的NaOH、Na2CO3、AlCl3、NH4HSO4溶液,为鉴别四瓶溶液,将四瓶溶液编号为A、B、C、D进行实验。实验过程记录如下: B逐滴加入A中先产生白色沉淀X,继续加入B沉淀消失得无色溶液W;B与C中混合加热得无色气体Y,将Y通入紫色的石蕊试液中,石蕊试液变蓝;C和D以2:1混合得无色无味的气体Z,将Z通入紫色的石蕊试液,石蕊试液变红。根据实验现象请回答:
(1)Y、Z的化学式分别为:Y ;Z
X与B反应的离子方程式为 。
(2)D溶液pH (填“大于”、“小于”或“等于”)7,原因是(用离子方程式表示): 。
(3)等物质的量浓度的A、B、C、D溶液pH由大到小的顺序是 。(用化学式表示)
(4)请写出C与过量B反应(加热)的离子方程式 。
( 8分)亚铁盐在空气中易被氧化,但形成复盐可稳定存在。硫酸亚铁铵[(NH4)2SO4•FeSO4•6H2O]是一种重要化学试剂,实验室可用纯铁片来制
8分)亚铁盐在空气中易被氧化,但形成复盐可稳定存在。硫酸亚铁铵[(NH4)2SO4•FeSO4•6H2O]是一种重要化学试剂,实验室可用纯铁片来制 取硫酸亚铁铵,流程如下:
取硫酸亚铁铵,流程如下:
请回答下列问题:
(1)操作Ⅰ的名称是 ,所用主要仪器和用品有(铁架台、铁圈除外)
,所用主要仪器和用品有(铁架台、铁圈除外)
。
(2)若A物质为CuSO4,其加入的目的是 ,则固体B的成分为 。
(3)加少量硫酸可以调节pH为 1~2,其作用是 。