磷、硫元素的单质和化合物应用广泛。
(1)磷元素的原子结构示意图是____________。
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:2Ca3(PO4)2+6SiO2===6CaSiO3+P4O10 10C+P4O10===P4+10CO
每生成1 mol P4时,就有________mol电子发生转移。
(3)硫代硫酸钠(Na2S2O3)是常用的还原剂。在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量。发生的反应为:
C6H8O6+I2===C6H6O6+2H++2I- 2S2O32-+I2===S4O62-+2I-
在一定体积的某维生素C溶液中加入a mol·L-1 I2溶液V1 mL,充分反应后,用Na2S2O3溶液滴定剩余的I2,消耗b mol·L-1 Na2S2O3溶液V2 mL。该溶液中维生素C的物质的量是__________mol。
(4)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:
2IO3-+5SO32-+2H+===I2+5SO42-+H2O
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示:
| |
0.01mol·L-1KIO3酸性溶液(含淀粉)的体积/mL |
0.01mol·L-1 Na2SO3溶液的体积/mL |
H2O的体积/mL |
实验温度 /℃ |
溶液出现蓝色时所需时间/s |
| 实验1 |
5 |
V1 |
35 |
25 |
|
| 实验2 |
5 |
5 |
40 |
25 |
|
| 实验3 |
5 |
5 |
V2 |
0 |
|
该实验的目的是______________________________________________;表中V2=___________mL
II、稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位。
(5)铈(Ce)是地壳中含量最高的稀土元素。在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3·6H2O和NH4Cl固体混合物的方法来制备。其中NH4Cl的作用是
粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取20 g A全部溶于0.15 L 6.0 mol·L-1盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出1.12 L(标准状态)气体,同时生成溶液D,还残留有固体物质B;
④用KSCN溶液检验时,溶液D不变色。
请填写:
(1)产物中的单质B是_________________。
(2)②中所发生的各反应的化学方程式是___________________,______________________。
(3)③中所发生的各反应的离子方程式是
___________________________________________。
(4)若溶液D的体积仍视为0.15 L,则该溶液c(Mg2+)为____________________,c(Fe2+)为_____________________。
(1)浓硫酸与木炭粉在加热条件下的化学方程式为_________________________。
(2)已知酸性KMnO4溶液可以吸收SO2,试用图4-6所示各装置设计一个实验,验证上述反应所产生的各种产物。
这些装置的连接顺序(按产物气流从左到右的方向)是(填装置的编号):
__________→__________→__________→__________。
(3)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色。A瓶溶液的作用是______________________,B瓶溶液的作用是____________________,C瓶溶液的作用是_________________________。
(4)装置②中所加的固体药品是_______________,可确证的产物是_______,确定装置②在整套装置中位置的理由是_____________________。
(5)装置③中所盛溶液是__________,可验证的产物是__________。
在某NaOH溶液里加入几滴酚酞试液,溶液显红色,向其中逐滴加入新制的饱和氯水,当滴到最后一滴时,红色突然褪去。回答下列问题:
(1)产生该现象的原因可能有:
①__________________________;
②__________________________。
(2)简述怎样用实验证明红色褪色的原因是①或者是②。
____________________________________。
已知氧化性BrO3->ClO3->Cl2>IO3->I2。现将饱和氯水逐滴滴入KI淀粉溶液中至过量。
(1)可观察到的现象是:
①______________________________________________________________
②______________________________________________________________
(2)写出有关的离子方程式:
①_______________________________________________________________
②_______________________________________________________________
海水的综合利用可以制备金属镁,其流程如下图所示:
(1)写出①、③、⑥反应的化学方程式:
① , ③ , ⑥ 。
(2)在反应①→⑥中属于氧化还原反应的是 。
(3)
Mg(OH)2沉淀中混有的Ca(OH)2应怎样除去?写出实验步骤。
。
(4)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的;
溶解时: 。过滤时: 。蒸发时: 。
关于卤化银分解实验的设计
有关卤化银的感光性,可按以下方法来进行实验:
试剂和仪器: 0.1 mol·L-1的NaCl、NaBr、KI溶液,2%的AgNO3溶液。500 mL圆底烧瓶、大烧杯、聚光电筒。
实验步骤:
(1)将3只预先注有4/5容积蒸馏水的圆底烧瓶用大烧杯垫托安置于讲台上,使之处于较好的视觉高度,编号。
(2)依次往上述烧瓶中加入2至5 mL NaCl、NaBr和KI溶液,振荡摇匀。
(3)慢慢地往烧瓶中滴加AgNO3溶液,边滴边振荡,可三名同学同时操作,3种胶体同时制作,便于比较。注意观察胶体形成的效果,要求胶体颜色明显,无浑浊状态。
(4)胶体制备好后,记录时间,用聚光电筒进行爆光(或置于阳光下),观察分解反应的速度及颜色等现象的变化,做好记录。
结论:分解速率:在同样光照条件下,AgBr分解最快,先由浅黄色透明状变成灰黑色浑浊态,时间约2 min;AgCl次之,由乳白透明状变成灰白浑浊态;AgI最慢,较长时间才略有变化。
问题:
1.你认为本实验有何优点?
2.18世纪70年代.瑞典化学家舍勒在研究一种白色、难溶于水的盐时发现,在黑暗中此盐并无气味,而在光照时开始变黑并有刺激性气味的气体产生。此盐是
A.氟化银 A.氯化银 C.溴化银 D.碘化银
海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下图:
(1)指出制取碘的过程中有关的实验操作名称:
① ;② 。
(2)提取碘的过程中.可供选择的有机试剂是 。
| A.甲苯、酒精 | B.四氯化碳、苯 | C.汽油、乙酸 | D.汽油、甘油 |
(3)为使海藻灰中碘离子转化为碘的有机溶液.实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品.尚缺少的玻璃仪器是 。
(4)从含碘的有机溶液中提取碘和回收有机溶液,还需要经过蒸馏。观察上述实验装置指出其错误之处,并加以改正。
(5)进行上述蒸馏操作时.使用水浴的原因是
。最后晶态碘在 里聚集。
某同学为了验证海带中含有碘,拟进行如下实验,请回答相关问题。
(1)第1步:灼烧。操作是将足量海带灼烧成灰烬。该过程中将使用到的硅酸盐质实验仪器有 (填代号、限填3项)。
A.试管 B.瓷坩埚 C.坩埚钳 D.铁三角架 E.泥三角 F.酒精灯 D.烧杯 H.量筒
(2) 第2步:I-溶液的获取。操作是 。
(3)第3步:氧化。操作是依次加入合适的试剂。下列氧化剂最好选用 (填代号)。
A.浓硫酸 B.新制氯水 C.KMnO4溶液 D.H2O2
理由是 。
(4) 第4步:碘单质的检验。操作是取少量第3步的溶液,滴加淀粉溶液,如果溶液显蓝色,则证明海带中含碘。
海水占地球总储水量的97.2%,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源。

(1)目前,国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经冷却而得高纯度淡水。由此可判断蒸馏法是 (填:物理变化或化学变化)。
(2)工业上利用电解饱和食盐水可制得重要化工产品。反应式为:食盐+H2O ® NaOH+H2+Cl2(未配平),该反应中食盐的化学式是 ;利用电解所得气体制36.5%的浓盐酸1000 t,最少需消耗食盐 t。
(3)近年来,有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法。该方法流程如下:
请写出②④的化学反应方程式: 、 。
在已经提取氯化钠、溴、镁等化学物质的富碘卤水中,采取下面的工艺流程生产单质碘。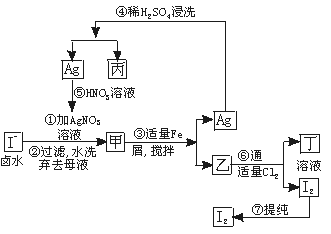
试回答下列问题:
(1)乙、丁中溶质的化学式:乙________________;丁_____________________。
(2)第④步操作中用稀H2SO4浸洗的目的是_____________________(填写字母编号)
| A.除去未反应的NO3- |
| B.除去未反应的I |
| C.除去未反应的Fe |
| D.除去碱性物质 |
(3)第⑦步操作可供提纯I2的两种方法是___________和______________(不要求写具体步骤)。
(4)实验室检验I2的方法是_______________________________________。
(5)甲物质见光易变黑,其原因是(用化学方程式表示)______________________。
在下图装置中,烧瓶中充满干燥气体A,将滴管中的液体B挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹,尖嘴管有液体呈喷泉状喷出,最终几乎充满烧瓶。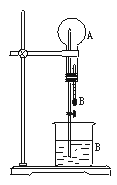
(1)若A为HCl气体,B为石蕊试液,则形成红色的喷泉。试分析红色喷泉形成的原因。
(2)请你根据喷泉形成的原理,选择适当的A和B来完成喷泉实验(至少通过三种途径且其中一种喷泉为有色)。将你的选择填入下表。
| |
A |
B |
喷泉颜色 |
| 途径1 |
|
|
|
| 途径2 |
|
|
|
| 途径3 |
|
|
|
(3)已知气体压强p、体积V、温度T、物质的量n之间的关系可用克拉珀龙方程式表示:pV=nRT(R为常数).你能否根据此关系再找出能够完成喷泉实验的其他条件?