已知A、B为单质,C为化合物。则下列说法正确的是( )
A+B C
C C溶液
C溶液 A+B
A+B
①若C溶于水后得到强碱溶液,则A可能是Na
②若C溶液遇Na2CO3放出CO2气体,则A可能是H2
③若C溶液中滴加KSCN溶液显血红色,则B可能为Fe
④若C溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu
A.①② B.③④ C.①③ D.②④
铵明矾 是分析化学常用基准试剂,其制备过程如下。下列分
是分析化学常用基准试剂,其制备过程如下。下列分
析不正确的是

A.过程I反应: |
| B.检验溶液B中阴离子的试剂仅需BaCl2溶液 |
| C.若省略过程II则铵明矾产率明显减小 |
| D.向铵明矾溶液中逐滴加入NaOH溶液先后观察到:刺激性气体逸出→白色沉淀 |
生成→白色沉淀消失
向18.4g铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,同时生成NO2、NO混合气体,再向所得溶液中加入足量的NaOH溶液,生成30.3g沉淀.另取等质量的合金,使其与一定量的氯气恰好完全反应,则氯气的体积在标准状况下为( )
| A.7.84L | B.6.72L | C.4.48L | D.无法计算 |
类比是研究物质性质的常用方法之一,可预测许多物质的性质。但类比是相对的,不能违背客观事实。下列各种类比推测的说法中正确的是
①已知Fe与S能直接化合生成FeS,推测Cu与S可直接化合生成CuS
②已知CaCO3与稀硝酸反应生成CO2,推测CaSO3与稀硝酸反应生成SO2
③已知CO2分子是直线型结构,推测CS2分子也是直线型结构
④已知Fe与CuSO4溶液反应,推测Fe与AgNO3溶液也能反应
⑤已知NaOH是强电解质,其饱和溶液导电能力很强,Ca(OH)2也是强电解质,推测其饱和溶液导电能力也很强
| A.①③④ | B.①②⑤ | C.③④ | D.③④⑤ |
用右图所示装置进行相应的实验,能达到实验目的或得出相应结论的是
| |
① |
② |
③ |
实验结论或目的 |
 |
| A |
浓盐酸 |
KMnO4 |
石蕊试液 |
氯气的水溶液有酸性、漂白性 |
|
| B |
稀硫酸 |
Na2S |
AgNO3与AgCl的浊液 |
Ksp(AgCl)>Ksp(Ag2S) |
|
| C |
硝酸 |
Na2CO3溶液 |
Na2SiO3溶液 |
比较硝酸、碳酸、硅酸酸性强弱 |
|
| D |
溴水 |
FeBr3、苯 |
AgNO3溶液 |
苯和溴水能发生取代反应 |
下列实验操作能达到目的的是
| A.用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液 |
| B.制取二氧化氮时,用水或NaOH溶液吸收尾气 |
| C.为测定Na2CO3和NaHCO3混合物中Na2CO3质量分数,取a g混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b g,该方案可行。 |
| D.为测定镀锌铁皮的锌层厚度,将镀锌铁皮与足量盐酸反应待气泡明显减少时取出, |
洗涤,烘干,称重。若烘干时间过长,会导致测定结果偏小。
下列设计的实验方案能达到实验目的是( )
| A.制备Al(OH)3悬浊液:向1mol•L﹣1AlCl3溶液中加过量的6mol•L﹣1NaOH溶液 |
| B.提纯含有少量乙酸的乙酸乙酯:向含有少量乙酸的乙酸乙酯中加入过量饱和氢氧化钠溶液,振荡后静置分液,并除去有机相的水 |
| C.检验溶液中是否含有Fe2+:取少量待检验溶液,向其中滴加KSCN溶液,再加入少量新制氯水,观察实验现象 |
| D.探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2mL5%H2O2和1mLH2O,向另一支试管中加入2mL5%H2O2和1mLFeCl3溶液,观察并比较实验现象现象 |
现有Na2CO3、H2SO4、Ba(OH)2三种物质的量浓度与体积都相等的溶液,若以不同顺序将它们中的两种混合起来,出现沉淀后过滤,再将滤液与第三种溶液混合起来,最终所得的溶液( )
| A.可能呈酸性 | B.可能呈中性 | C.一定呈碱性 | D.一定呈中性 |
在复杂体系中,确认化学反应先后顺序有利于解决问题.下列反应先后顺序判断正确的是
| A.在含等物质的量的Fe2+、Ag+、Cu2+、H+的溶液中加入Zn: Ag+、Cu2+、H+、Fe2+ |
| B.在含等物质的量的AlO2-、OH-、CO32-溶液中,逐滴加入盐酸: AlO2-、Al(OH)3、OH-、CO32- |
| C.在含等物质的量的Ba(OH)2、KOH的溶液中通入CO2: KOH、Ba(OH)2、BaCO3 |
| D.在含等物质的量的FeBr2、FeI2的溶液中缓慢通入Cl2:I-、Br-、Fe2+ |
“绿色化学实验”进课堂,某化学教师为“氯气与金属钠反应”设计了如下装置与操作以替代相关的课本实验.实验操作:钠与氯气反应的装置可作如图改进,将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球。先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述错误的是
| A.反应生成的大量白烟是氯化钠晶体 |
| B.玻璃管尾部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气 |
| C.钠着火燃烧产生苍白色火焰 |
| D.若在棉球外沿滴一滴紫色石蕊溶液,可根据其颜色变化判断氯气是否被碱液完全吸收 |
铜和镁的合金4.6 g完全溶于一定量的浓硝酸,若反应中硝酸被还原只产生1792 mL的NO2气体和1120 mL的NO气体(都已折算到标准状况),在反应后的溶液中加入足量的氢氧化钠溶液,生成沉淀的质量为
| A.7.04 g | B.8.26 g | C.8.51 g | D.9.02 g |
下图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。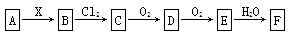
下列说法中不正确的是
A.当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B.当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C.B和Cl2的反应是氧化还原反应
D.当X是强酸时,C在常温下是气态单质
下列实验操作、现象和结论均正确的是
| 选项 |
实验操作 |
现象 |
结论 |
| A |
铜放入稀硫酸中,再加入硝酸钠固体 |
开始无明显现象,后溶液变蓝,有气泡放出,铜溶解 |
硝酸钠可以加快铜与稀硫酸的反应速率 |
| B |
在KIO3溶液中加入HI溶液,并加入淀粉 |
溶液变成蓝色 |
KIO3的氧化性比I2强 |
| C |
向CH2=CHCH2OH中滴入酸性高锰酸钾溶液 |
紫红色褪去 |
证明CH2=CHCH2OH中含有碳碳双键 |
| D |
向Na2S溶液中加入酚酞,再滴加稀盐酸 |
溶液先变红,后红色变浅直至消失 |
证明非金属性:Cl>S |
对溶液中的反应,如图像中m表示生成沉淀的物质的量,n表示参加反应的某一种反应物的物质的量,则下列叙述中错误的是:
| A.符合甲图像的两种反应物可以是AlCl3和NaOH |
| B.符合乙图像的两种反应物可以是Ca(OH)2和CO2 |
| C.符合丙图像的反应可以是在Ca(OH)2和KOH的混合溶液中通入CO2 |
| D.符合丙图像的反应可以是在NH4Al(SO4)2溶液中加入NaOH |
已知NH4++AlO2-+2H2O=Al(OH)3↓+NH3·H2O。向含有等物质的量的NH4Cl、AlCl3和HCl混合溶液中慢慢滴加NaOH溶液至过量,并不断搅拌,可能发生以下离子反应:
①H++OH-=H2O; ②Al(OH)3+OH-=AlO2-+2H2O; ③Al3++3OH-=Al(OH)3↓;
④NH4++OH-=NH3·H2O; ⑤NH4++AlO2-+2H2O=Al(OH)3↓+NH3·H2O。
其正确的离子反应顺序是
| A.①③②④ | B.①③④② | C.①③②⑤ | D.①④③② |