A、B、C、D为四种单质,常温时,A、B是气体,C、D是固体。E、F、G、H、I为五种化合物,F不溶水,E为气体且极易溶水成为无色溶液,G溶于水得黄棕色溶液。这九种物质间反应的转化关系如图所示

(1)写出四种单质的化学式
A________ B_______ C______ D______
(2)写出H+B→G的离子方程式 ;
(3)写出G+I→H+D+E的化学方程式 ;
(4)某工厂用B制漂白粉。
①写出制漂白粉的化学方程式 。
②为测定该工厂制得的漂白粉中有效成分的含量,某该小组进行了如下实验:称取漂白粉3.0g,研磨后溶解,配置成250mL溶液,取出25.00mL加入到锥形瓶中,再加入过量的KI溶液和过量的硫酸(此时发生的离子方程式为: ),静置。待完全反应后,用0.2mol·L-1的Na2S2O3溶液做标准溶液滴定反应生成的碘,已知反应式为:2Na2S2O3+I2 =Na2S4O6+2NaI,共用去Na2S2O3溶液20.00mL。则该漂白粉中有效成分的质量分数为 保留到小数点后两位)。
下列用数轴表示的产物与量的关系不合理的是( )
| A.铁与稀硝酸反应: |
 |
| B.Cl2与FeI2溶液反应后的产物: |
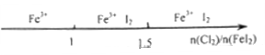 |
| C.向烧碱液中通入SO2后的产物: |
 |
| 向AlCl3溶液中滴加NaOH溶液,铝元素的存在形式: |
 |
短周期元素形成的纯净物A、B、C、D、E之间的转化关系如下图所示,A与B之间的反应不在溶液中进行(E可能与A、B两种物质中的一种相同)。
请回答下列问题:
(1)若A是气态单质,D是一种强碱。
①B的化学式为________或__________。
②C的电子式为________。
(2)若E的水溶液呈弱酸性,D是既能溶于强酸、又能溶于强碱的化合物。
①用电离方程式解释D既能溶于强酸、又能溶于强碱的原因_____________________。
②用等式表示E与NaOH溶液反应生成正盐的溶液中所有离子的浓度之间的关系_______________。
(3)若C是一种气体,D是一种强酸。
①写出C与水反应的化学方程式为______。
②有人认为“浓H2SO4可以干燥气体C”。某同学为了验证该观点是否正确,用如图所示装置进行实验。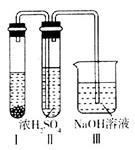
装置I中的试剂为_______;实验过程中,在浓H2SO4中未发现有气体逸出,则得出的结论是______________。
某强酸性溶液X,可能含有Al3+、Ba2+、NH4+ 、Fe2+、Fe3+、CO32-、SO42-、SiO32-、NO3-中的一种或几种离子,取该溶液进行实验,其现象及转化如下图。反应过程中有一种气体是红棕色。请回答下列问题:

(1)由强酸性条件即可判断溶液X中一定不存在的离子有 。
(2)溶液X中,关于NO3-的判断一定正确的是_ ___。
a.一定有 b.一定没有 c.可能有
(3)产生气体A的离子方程式为 。
(4)转化⑥发生反应的现象为 。
(5)转化④中产生H的离子方程式为 。
(6)若转化③中,D、H2O、O2三种物质恰好发生化合反应生成E,则反应中D与O2的物质的量之比为____。
(7)对不能确定是否存在的离子,可以另取X溶液,加入下列溶液中的一种,根据现象即可判断,该试剂最好是 。
①NaOH溶液,②KSCN溶液,③石蕊试剂,④pH试纸,⑤KMnO4溶液,⑥氯水和KSCN的混合溶液
某课外学习小组对日常生活中不可缺少的调味品M进行探究。已知C可在D中燃烧发出苍白色火焰。M与其他物质的转化关系如下图所示(部分产物已略去):
(1)写出用惰性电极电解M溶液的离子方程式__________。写出F的电子式___________。
(2)若A是一种常见的酸性氧化物,且可用于制造玻璃,E溶液与F溶液反应可以制备一种胶体,则E溶液的俗称是______________。
(3)若A是CO2气体,A与B溶液能够反应,反应后所得的溶液再与盐酸反应,如图所示,“则A与B溶液”反应后溶液中的溶质化学式为________。
(4)若A是一种化肥。实验室可用A和B反应制取气体E,E与F、E与D相遇均冒白烟,且利用E与D的反应检验输送D的管道是否泄露,写出E与D反应的化学方程式是______________.
V、W、X、Y、Z是由四种短周期元素中的两种或三种组成的5种化合物,其中W、X、Z均由两种元素组成,X是导致温室效应的主要气体,Z是天然气的主要成分,Y、W都既能与酸反应,又能与强碱溶液反应。上述5种化合物涉及的四种元素的原子序数之和等于28;V由一种金属元素和两种非金属元素组成,其原子个数比为1︰3︰9,所含原子总数等于其组成中金属元素的原子序数。它们之间的反应关系如下图:

(1)写出W物质的一种用途 。
(2)写出V与足量NaOH溶液反应的化学方程式 。
(3)将过量的X通入某种物质的水溶液中可以生成Y,该反应的离子方程式为 。
(4)4 g Z完全燃烧生成X和液态水放出222.5 kJ的热量,请写出表示Z燃烧热的热化学方程式 。
(5)在200 mL 1.5 mol·L-1 NaOH溶液中通入标准状况下4.48 L X气体,完全反应后所得溶液中,各种离子浓度由大到小的顺序是 。
(6)Y是一种难溶物质,其溶度积常数为1.25×10-33。将0.01 mol Y投入1 L某浓度的盐酸中,为使Y完全溶解得到澄清透明溶液,则盐酸的浓度至少应为 (体积变化忽略不计,结果保留三位有效数字)。
I.甲、乙、丙三种物质之间有如下转化关系:

甲和丙都是不溶于水的白色固体物质,既能溶于盐酸又能溶于氢氧化钠溶液.
(1)则甲是______,丙是________(填化学式)。
(2)写出“ ”转化的离子方程式:__________。
”转化的离子方程式:__________。
II.右图表示A——E 五种物质的相互转化关系,其中A为淡黄色粉末,C为单质,D为离子化合物。
(1)写出③、⑧的化学方程式:③______________; ⑧_____________________.
(2)写出反应④的离子方程式:___________________。

下列物质A~F是我们熟悉的单质或化合物,其中A、B均是常见的金属;E在常温下是黄绿色气体;在适当的条件下,它们之间可以发生如下图所示的转化。

试回答下列问题:
(1)写出无色溶液中溶质的化学式: ;写出E的电子式 。
(2)写出C到白色沉淀的化学方程式是 。
(3)反应F→D的离子方程式是 。
有A、B、C、D四种化合物,分别由K+、Ba2+、SO 、CO
、CO 、OH-中两种组成,它们具有下列性质:①A不溶于水和盐酸;②B不溶于水但溶于盐酸并放出无色无味的气体E;③C的水溶液呈碱性,与硫酸反应生成A;④D可溶于水,与硫酸作用时放出气体E,E可使澄清石灰水变浑浊。
、OH-中两种组成,它们具有下列性质:①A不溶于水和盐酸;②B不溶于水但溶于盐酸并放出无色无味的气体E;③C的水溶液呈碱性,与硫酸反应生成A;④D可溶于水,与硫酸作用时放出气体E,E可使澄清石灰水变浑浊。
(1)推断A、B、C、D、E的化学式。
A ;B ;C ;D ;E ;
(2)写出下列反应的离子方程式。
D与硫酸反应 。
B与盐酸反应 ;
C与硫酸反应 ;
某强酸性溶液X,含有Ba2+、Al3+、SiO32-、NH4+、Fe2+、Fe3+、CO32-、SO42-、NO3-中的一种或几种离子,取溶液进行连续实验,能实现如下转化:
依据以上信息,回答下列问题:
(1)上述离子中,溶液X中肯定含有的是:________________;不能肯定的是:_______________。对不能确定是否存在的离子,可以另取X溶液于一支试管中,选择下列试剂中的一种加入X溶液中,根据现象就可判断,则该试剂是:_________。(选填:①NaOH溶液,②酚酞试剂,③石蕊试剂,④pH试纸,⑤KSCN溶液,⑥KMnO4溶液)
(2)气体F的电子式为:_______________,实验中,可以观察到反应②的现象是:__________________。
(3)写出步骤①所有发生反应的离子方程式________________________、___________________。
有甲、乙、丙、丁四种无色溶液,它们分别是HCl、H2SO4、BaCl2、Na2CO3溶液中的一种。为区别这四种溶液,现将它们两两混合并得到下面现象:
| 溶液 |
甲+乙[来 |
乙+丙 |
丙+丁 |
甲+丁 |
| 现象 |
无明显现象 |
白色沉淀 |
白色沉淀 |
无色气体 |
根据对上述现象的分析,可推知甲、乙、丙、丁四种溶液的顺序依次是
A.HCl、BaCl2、H2SO4、Na2CO3
B.H2SO4、HCl、BaCl2、Na2CO3
C.HCl、H2SO4、BaCl2、Na2CO3
D.H2SO4、Na2CO3、HCl、BaCl2
化合物A是尿路结石的主要成分,属于结晶水合物,可用X·nH2O表示。在一定条件下有如下图所示的转化关系:

已知:
①经分析,上图中的各字母代表的物质均由常见元素(原子序数≤20)组成,其中X由三种元素组成;A、D晶体中阴、阳离子个数比都是1∶1;D中的阳离子与C分子有相同的电子数,A中的阳离子与D中的阴离子的电子层结构相同。
② G、H是常见的气体单质,E、K、L是常见的气体化合物;E被人体吸入会与血红蛋白结合而使人中毒,K的大量排放是造成地球温室效应的一个主要原因。
③反应②、③是重要的化工反应,I是一种重要的化工原料。
④上图中的部分变化经定量测定,得到如右图所示的固体产物的质量m随温度[t (℃)]的变化曲线。回答下列问题:

(1)写出A的化学式: ,D中阴离子的结构示意图为 ;
(2)反应①的化学方程式为: 。
(3)K与G在一定条件下可生成多种物质,既可获得经济效益,也减少对环境的污染。
① 若O是一种易挥发的液态燃料,有毒,误饮5-10mL会导致双目失明。则O的分子式为: 。
② 若O是K与G按1∶3的比例反应而得,则O可能是 。(填编号)
A.烷烃 B.烯烃 C.炔烃 D.芳香烃
X、Y、Z是三种常见元素的单质,甲乙是两种常见的化合物,这些单质和化合物之间存在如图所示的关系,下列说法正确的是
| A.X、Y、Z都是非金属单质 |
| B.X、Y、Z中至少有一种是金属单质 |
| C.如果X、Y都为非金属单质,则Z必为金属单质 |
| D.如果X、Y都为金属单质,则Z必为非金属单质 |
(13分)A、B、D是由常见的短周期非金属元素形成的单质,常温下A是淡黄色粉末,B、D是气体,F、G、H的焰色反应均为黄色,水溶液均显碱性,E有漂白性。它们之间的转化关系如图所示(部分产物及反应条件已略去),回答下列问题:

(1)A所含元素在周期表中的位置为 ,C的电子式为 。
(2)A与H在加热条件下反应的离子方程式为 。
(3)将A溶于沸腾的G溶液中可以制得化合物I,I在酸性溶液中不稳定,易生成等物质的量的A和E,I在酸性条件下生成A和E的离子方程式为 。I是中强还原剂,在纺织、造纸工业中作为脱氯剂,向I溶液中通入氯气可发生反应,参加反应的I和氯气的物质的量比为1:4,该反应的离子方程式为 。
(4)向含有0.4mol F、0.1 mol G的混合溶液中加入过量盐酸,完全反应后收集到a L气体C(标准状况),取反应后澄清溶液,加入过量FeCl3溶液,得到沉淀3.2g,则a= 。
(9分)甲、乙、丙均为化合物,其中甲为淡黄色的固体,乙常温下为无色无味液体,丙为常见的无色无味气体。它们有如下图的转化关系,已知D为黄绿色气体,按要求回答下列问题:
(1)甲物质为_____________(填化学式)。
(2)1mol乙和足量甲反应可生成______________mol B物质;1mol丙和足量甲反应可生成____________mol B物质。
(3)D能使湿润的有色布条褪色,其褪色原因是______________________。
(4)丙与溶液F反应的化学方程式为_____________________。