下列说法正确的是( )
| A.浓硫酸用铜制容器密封保存 | B.SO2能使溴水褪色,体现其漂白性 |
| C.氨气是电解质,因为氨气的水溶液能导电 | D.光导纤维的主要成分是二氧化硅 |
下列各组反应中,硝酸既表现氧化性,又表现酸性的是( )
| A.C+HNO3 | B.H2S+HNO3 | C.Fe(OH)3+HNO3 | D.Cu+HNO3 |
下列说法正确的是( )
| A.酸性氧化物都不能与酸发生反应 |
| B.氯水中的次氯酸具有杀菌消毒的作用 |
| C.铵盐受热分解都能放出氨气 |
| D.生物固氮是指植物通过叶面直接吸收空气中的氮气 |
足量铜与一定量浓硝酸反应后过滤,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,将这些气体与3.36 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得溶液中加入1 mol/L NaOH溶液至Cu2+恰好完全沉淀,将沉淀过滤、洗涤、干燥、灼烧后得到黑色固体,则所得黑色固体的质量是( )
| A.12g | B.16g | C.24g | D.48g |
标况下,将一盛有等体积NO、NO2的试管倒立在水槽中,充分反应后,下列叙述不正确的是(设试管中的溶质不往试管外扩散)( )
| A.此反应中水既不是氧化剂又不是还原剂 |
B.试管内溶液中溶质的物质的量浓度为 |
| C.溶液体积占试管容积的三分之二 |
| D.若将试管中的气体换为氯化氢或者氨气,则水充满试管 |
化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应的特殊情况”。下列反应中属于这种情况的是( )
①过量的锌与18mol▪L-1的硫酸反应;
②过量的氢气与少量氮气在催化剂存在下充分反应;
③浓盐酸与过量的MnO2反应;
④过量铜与18mol▪L-1的硫酸反应;
⑤过量硝酸与银反应;
⑥过量稀硫酸与块状石灰石反应。
| A.②③④⑥ | B.②③⑤ | C.①④⑤ | D.①②③④⑤⑥ |
将铜片放入盛有足量稀硫酸的烧杯中,若使铜片溶解,则不能在烧杯中加入( )
| A.三氯化铁固体 | B.硝酸铵固体 | C.稀硝酸溶液 | D.硫酸亚铁固体 |
下列叙述不正确的是( )
| A.H2S与SO2、NO与O2、NH3与HCl在常温下均不能大量共存 |
| B.(NH4)2SO3、Ca(ClO)2、NaAlO2均既能和稀硫酸又能和氢氧化钠溶液反应 |
| C.Fe(OH)3、FeCl2、FeCl3、NO均可通过化合反应得到 |
| D.AlCl3、Fe3O4、NaOH都可通过置换反应一步得到也可通过化合反应一步得到 |
在15.2 g铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,同时生成气体X,再向所得溶液中加入足量的NaOH溶液,生成25.4 g沉淀,则下列表示气体X组成的选项中合理的是
| A.0.3 mol NO、0.1 mol NO2 | B.0.3 mol NO2、0.1 mol NO |
| C.0.6 mol NO | D.0.3 mol NO2 |
科学家曾预言一种可用作炸药的物质,分子式为C(N3)4,其爆炸反应方程式为:C(N3) 4→ C+6N2↑,下列说法一定错误的是
| A.该物质为离子晶体 |
| B.该物质可用通过C60吸附N2而制得 |
| C.C(N3) 4中碳元素为正价 |
| D.18g该物质完全分解可以产生13.44升(标准状况)氮气 |
将含有少量杂质的硝酸铜固体用酒精灯加热至恒重,收集到20.20 mL气体,再将该气体用足量水吸收,剩余2.10 mL气体(气体体积在同温同压下测定),则关于杂质成分的推测不合理的是
| A.NaNO3 | B.Mg(NO3)2 |
| C.AgNO3 | D.NaNO3和AgNO3的混合物 |
将相同质量的两块铜片分别和浓硝酸、稀硝酸(两者均过量)反应,下列叙述正确的是
| A.反应速率:两者相同 |
| B.消耗HNO3的物质的量:前者多,后者少 |
| C.反应生成气体的颜色:前者浅,后者深 |
| D.反应中转移的电子总数:前者多,后者少 |
丰富多彩的颜色变化增添了化学实验的魅力,下列有关反应颜色变化的叙述中,正确的是:
①氯气通入湿润的蓝色石蕊试纸后→红色
②无水硫酸铜遇水蒸气→蓝色
③蔗糖中加入浓硫酸搅拌→白色
④SO2通入高锰酸钾溶液中→紫红色褪去
⑤氨气通入酚酞溶液中→红色
| A.①②④⑤ | B.②③④⑤ | C.①④⑤ | D.①②③④⑤ |
下图是产生和收集气体的实验装置,该装置最适合于 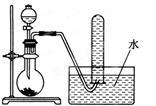
| A.用浓盐酸和MnO2反应制取Cl2 |
| B.用浓硫酸与Na2SO3反应制取SO2 |
| C.用H2O2溶液和MnO2反应制取O2 |
| D.用NH4Cl浓溶液和Ca(OH)2浓溶液反应制取NH3 |