将51.2gCu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8mol,这些气体恰好能被500ml 2mol/LNaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液,其中NaNO2的物质的量为
(已知NO+NO2+2NaOH===2NaNO2+H2O,2NO2+2NaOH===NaNO3+NaNO2+H2O)
| A.0.8mol | B.0.6mol | C.0.2mol | D.1.0mol |
在给定条件下,下列划横线的物质在化学反应中能被完全消耗的是
| A.标准状况下,将1 g铝片投入20 mL 18.4 mol·L-1的硫酸中 |
| B.向100 mL 3 moI·L-1的硝酸中加入5.6 g铁 |
| C.用50 mL 18 mol·L-1浓硫酸与足量Cu共热(指其中的硫酸被完全消耗) |
| D.在5×107 Pa、500 ℃和铁触媒催化的条件下,用3 mol氢气和2 mol氮气合成氨 |
(12分) HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
(1)人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述
不正确的是________(填序号)。
A.亚硝酸盐被还原
B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+
D.亚硝酸盐是还原剂
(2)下列方法中,不能用来区分NaNO2和NaCl的是________(填序号)。
A.测定这两种溶液的pH
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI—淀粉溶液来区别
D.用AgNO3和HNO3两种试剂来区别
(3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:_________________________。
(4) Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是________(填序号)。
a.Cl2 b.Fe c.H2O2 d.HNO3
(5)若FeSO4和O2的化学计量数比为2∶1,试配平下列方程式:
FeSO4+K2O2——K2FeO4+K2O+K2SO4+O2↑
(6)高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,在水中发生反应生成氢氧化铁胶体。高铁酸钾作为水处理剂发挥的作用是_____________________。
(14分)尿素可作为H2O2的稳定载体,生产一种固态、耐储存、易运输的新型氧化剂和消毒剂—过氧化尿素[CO(NH2)2·H2O2],其合成工艺流程如下:
请回答下列问题:
(1)操作I、II的名称分别是________、_________。CO(NH2)2·H2O2分子中尿素和过氧化氢之间以________结合,其结合力较弱,具有尿素和过氧化氢双重性质。

(2)工业上生产尿素所需的原料气可由天然气与水反应制备,已知:
①甲烷、氢气的燃烧热分别为890.3kJ/mol、285.8kJ/mol
②H2O(l)=H2O(g) H =+44.0kJ/mol
写出CH4与水蒸气作用生产CO2和H2的热化学方程式: 。
(3)为测定产品中H2O2的含量,称取干燥样品12.0g配成250mL溶液,取25.00mL
于锥形瓶中,加入适量硫酸酸化,用0.20mol/LKMnO4标准溶液滴定,三次滴定平均消耗KMnO4溶液20.00mL.(KMnO4溶液与尿素不反应).
①完成并配平方程式:

②计算出产品中H2O2的质量分数为_____________。
(4)电解含尿素的废水既可以处理废水,又可制得纯氢,电解原理如图所示。电解池中隔膜仅阻止气体通过,A、B两极均为惰性电极。请写出阳极的电极反应方程为_____________。

在100mL密度为1.2g/mL稀硝酸中,加入一定量的镁和铜组成的混合物,充分反应后金属完全溶解(假设还原产物只有NO),向反应后溶液中加入3mol/L NaOH溶液至沉淀完全,测得生成沉淀质量比原金属质量增加5.1g。则下列叙述不正确是
| A.当金属全部溶解时收集到NO气体的体积为2.24L(标准状况) |
| B.当生成沉淀的量最多时,消耗NaOH溶液体积最小为100mL |
| C.原稀硝酸的物质的量浓度一定为4 mol/L |
| D.参加反应金属总质量(m)为9.6g>m>3.6g |
a mol FeS与b mol FeO投入到V L c mol·L-1的硝酸溶液中,恰好完全反应,还原产物只有NO,所得澄清溶液可看作是Fe(NO3)3与H2SO4的混合液,则反应中未被还原的硝酸可能为
①(a+b)×63g ;②(a+b)×189g;③(a+b)mol ;④(V•c— )mol
)mol
| A.①④ | B.②③ | C.①③ | D.②④ |
固体X只可能由A1、(NH4)2SO4 ,MgCl2.FeCl2, AlCl3, AgNO3中的一种或几种组成,某同学对该固体进行了如下实验
下列判断正确的是
| A.气体甲一定是纯挣物 | B.固体X中一定不存在FeCl2、AgNO3 |
| C.白色沉淀甲可能是混合物 | D.固体X中一定存在AlCl3、(NH4)2SO4, MgCl2 |
在标准状况下,将a L NH3完全溶于水得到V mL氨水(溶质以NH3来计),溶液的密度为ρ g/cm3,溶质的质量分数为w,溶质的物质的量浓度为c mol/L。下列叙述中正确的是
①w= ×100%
×100%
②c=
③向上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5 w
④向上述溶液中再加入1.5V mL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
| A.①③ | B.②③ | C.②④ | D.①④ |
NH3经一系列反应可以得到HNO3和NH4NO3,如下图所示。
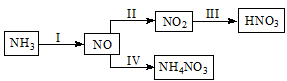
(1)I中,NH3和O2在催化剂作用下反应,其化学方程式是 。
(2)II中,2NO(g)+O2(g) 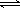 2NO2(g) 。起始时容器充入1molNO、0.5molO2,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线(如下图)。
2NO2(g) 。起始时容器充入1molNO、0.5molO2,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线(如下图)。
①比较p1、p2的大小关系 。
②在温度为500℃、压强为p2条件下,平衡混合气中NO2的体积分数 。
(3)III中,将NO2(g)转化成N2O4(l),再制备浓硝酸。
①已知:2NO2(g) 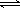 N2O4(g) ΔH1 2NO2(g)
N2O4(g) ΔH1 2NO2(g) 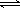 N2O4(l) ΔH2
N2O4(l) ΔH2
A B C
反应过程中能量变化正确的是 (填序号)。
②N2O4与O2、H2O化合的化学方程式 。
工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。某同学设计了如下实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解).
(1)实验原理:①Al4C3与硫酸反应可生成CH4.②AlN溶于强酸产生铵盐,溶于强碱生成氨气,请写出AlN与过量NaOH溶液反应的化学方程式_____________________________。
(2)实验装置(如图所示):
(3)实验过程:
①连接实验装置,检验装置的气密性.称得D装置的质量为yg,滴定管的读数为amL。
②称取xgAlN样品置于装置B瓶中;塞好胶塞,关闭活塞K2、K3,打开活塞K1,通过分液漏斗加入稀硫酸,与装置B瓶内物质充分反应。
③待反应进行完全后,关闭活塞___________,打开活塞____________,通过分液漏斗加入过量________(填化学式),与装置B瓶内物质充分反应。
④_____________(填入该步应进行的操作)。
⑤记录滴定管的读数为bmL,称得D装置的质量为zg。
(4)数据分析:(已知:该实验条件下的气体摩尔体积为Vm L•mol-1)
①Al4C3的质量分数为___________。
②若读取滴定管中气体的体积时,液面左高右低,则所测气体的体积__________(填“偏大”、“偏小”或“无影响”)。
③AlN的质量分数为_______________。
HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+.AgNO2是一种难溶于水、易溶于酸的化合物.试回答下列问题:
(1)人体正常的血红蛋白含有Fe2+.若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为 Fe3+而中毒,服用维生素C可解毒.下列叙述不正确的是____________(填序号)。
A.亚硝酸盐被还原
B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+
D.亚硝酸盐是还原剂
(2)下列方法中,不能用来区分NaNO2和NaCl的是____________(填序号)。
A.测定这两种溶液的pH
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI-淀粉溶液来区别
D. 用AgNO3和HNO3两种试剂来区别
(3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:____________________。
(4)Fe与过量稀硫酸反应可以制取FeSO4.若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是___________(填序号)。
a.Cl2 b.Fe c.H2O2 d.HNO3
(5)若FeSO4和O2的化学计量数比为2:1,试配平下列方程式:
FeSO4+ K2O2→ K2FeO4+ K2O+ K2SO4+ O2↑
(6)高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,在水中发生反应生成氢氧化铁胶体.高铁酸钾作为水处理剂发挥的作用是______________________。
14分)氮是一种重要的非金属元素,可以形成多种不同类型的化合物,请根据要求回答下列问题:
(1)NA表示阿伏加德罗常数的数值。69g NO2和N2O4的混合气体中含有____________NA个氧原子;2L 0.6 mol/LFe(NO3)3溶液中含________NA个NO3-离子。
(2)三氟化氮(NF3)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,
①写出该反应的化学方程式 若反应中生成0.15 mol HNO3,转移的电子数目为________个.
②三氟化氮可由氨气和氟气反应得到:4NH3+3F2=NF3+3NH4F;据题意推测NF3、F2、NO三种气体中,氧化性由强到弱的顺序为________________________
③NF3是一种无色、无臭的气体,一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO2、NaF、H2O外,还肯定有___________________(填化学式).
(3)氨和联氨(N2H4)是氮的两种常见化合物,制备联氨可用丙酮为催化剂,将次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式 。
在标准状况下,将aLNH3完全溶于水得到VmL氨水,溶液的密度为ρg·cm-3,溶质的质量分数为ω,溶质的物质的量浓度为cmol/L。下列叙述中正确的是
①ω= ②c=
②c=
③上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
④上述溶液中再加入1.5VmL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
| A.①④ | B.②③ | C.①③ | D.②④ |
“8·12”天津港危化仓库爆炸,造成生命、财产的特大损失。据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN)。请回答下列问题:
(1)钠、钾着火,下列可用来灭火的是 。
A.水 B.泡沫灭火器 C.干粉灭火器 D.细沙盖灭
(2)NH4NO3为爆炸物,在不同温度下加热分解,可能发生非氧化还原反应,
可能发生氧化还原反应,下列反应可能发生的是 。
A.NH4NO3 → N2 + O2 + H2O
B.NH4NO3 → NH3 + HNO3
C.NH4NO3 → O2 + HNO3 + H2O
D.NH4NO3→ N2 + HNO3 +H2O
E.NH4NO3→N2+ NH3+ H2O
F.NH4NO3 →N2O + H2O
(3)NaCN属于剧毒物质,有多种无害化处理方法。
①H2O2处理法:NaCN + H2O2 —— N2↑+ X + H2O推测X的化学式为 。
② NaClO处理法:aCN-+bClO-+2cOH-= dCNO-+eN2↑+fCO32-+bCl-+cH2O
方程式中e : f的值为 (填选项标号)。
A.1 B.1/2 C.2 D.不能确定
(4)以TiO2为催化剂用NaClO将CN-离子氧化成CNO-,CNO-在酸性条件下继续与NaClO反应生成N2、CO2、Cl2等。取浓缩后含CN-离子的废水与过量NaClO溶液的混合液共200mL(设其中CN-的浓度为0.2mol·L—1)进行实验。
①写出CNO-在酸性条件下被NaClO氧化的离子方程式:______________;
②若结果测得CO2的质量为1.408g,则该实验中测得CN-被处理的百分率为 。
(1)向NH4Cl、AlCl3、MgCl2混合溶液中逐滴加入NaOH至过量,按反应的先后顺序,写出有关的离子方程式:
①______________________________
②______________________________
③______________________________
(2)含硫化合物的种类很多,常见的有:SO2、Na2SO4、H2SO4、CuSO4等。
① 向含FeCl3和BaCl2的酸性溶液中通入SO2,有白色沉淀生成,此沉淀是_____________
② 我国正在探索在一定条件下用CO还原SO2得到单质硫的方法来减少SO2的污染,写出该反应的化学方程式_______________________
③ Na2SO3和KIO3在酸性溶液中发生的反应叫碘酸盐型“碘钟”反应,常用淀粉作指示剂,写出KIO3过量时该氧化还原反应的离子方程式_______________________
(3) 实验室用固体烧碱配制500 mL 0.1 mol•L―1的NaOH溶液。
① 需称量________g的烧碱固体,它应该盛放在________中进行称量。
② 配制过程中,不需要使用的仪器是(填写代号)________。
A 烧杯 B 漏斗
C 1000 mL容量瓶 D 托盘天平
E 药匙 F 500 mL容量瓶 G 胶头滴管
③ 除上述可使用的仪器,还缺少的仪器是________,在实验中的作用___________。