将一定质量铜与100 mL一定浓度的硝酸反应,铜完全溶解时产生的NO和NO2混合气体在标准状况下的体积为11.2 L。待产生的气体全部释放后,向溶液加入140mL 5 mol·L-1的NaOH溶液,恰好使溶液中的Cu2+ 全部转化成沉淀,则原硝酸溶液的物质的量浓度是( )
| A.5 mol/L | B.7 mol/L | C.10mol/L | D.12 mol/L |
NO在人体内起着多方面的重要生理作用。下列关于NO的说法错误的是( )
| A.NO是汽车尾气的有害成分之一 |
| B.NO是红棕色气体 |
| C.在雷雨天可以生成NO |
| D.NO2与水反应有NO生成 |
下列方法中,能用于实验室制取氨的是
①在烧瓶中将熟石灰和氯化铵混合,加水调成泥状后加热
②加热试管中的氯化铵固体
③将烧瓶中的浓氨水加热
④将分液漏斗中的浓氨水滴入装有生石灰的烧瓶中
合成氨工业对国民经济和社会发展具有重要的意义,对密闭容器中的反应:
N2(g)+3H2(g) 2NH3(g) ;△H< 0 。 400℃、30MPa下n(NH3)和n(H2)随时间变化的关系如图,下列叙述错误的是( )
2NH3(g) ;△H< 0 。 400℃、30MPa下n(NH3)和n(H2)随时间变化的关系如图,下列叙述错误的是( )
| A.点a的正反应速率比b点的大 |
| B.点c处反应还未达到平衡 |
| C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样 |
| D.其他条件不变,500℃下反应至t1时刻, n(H2)比右图中d点的值大 |
在标准状况下,将一定量的氨气溶于水,得到密度为 a g·cm-3 的氨水 b g,物质的量浓度为 c mol·L-1,则溶于水中的氨气的体积是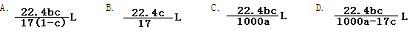
浓硝酸与下列物质的反应中,N元素化合价不会发生变化的是
| A.CaO | B.FeCl2 | C.Na2SO3 | D.Cu |
将盛有氮气和二氧化氮(假设无N2O4)混合气体的试管倒立于水中,经过足够长时间后,试管内气体的体积缩小为原来的一半,则原混合气体中氮气与二氧化氮的体积比是( )
| A.1:1 | B.1:2 | C.1:3 | D.3:1 |
下列变化属于氮的固定的是( )
| A.N2与H2在一定条件下反应生成NH3 |
| B.NO和O2反应生成NO2 |
| C.NH3经催化氧化生成NO |
| D.由NH3制NH4HCO3和(NH4)2SO4 |
计算题将32.64g铜与140一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合合气体在标准状况下的体积为11.2L.计算,
(1). NO、 NO2的体积分别为多少L ?
(2).待产生的气体全部释 放后,向溶液中加入VmL a mol/L的NaOH溶液,恰好使溶液中的Cu2+ 全部转化为沉淀,则原硝酸溶液中的浓度为多少mol/L?
放后,向溶液中加入VmL a mol/L的NaOH溶液,恰好使溶液中的Cu2+ 全部转化为沉淀,则原硝酸溶液中的浓度为多少mol/L?
NO与CO2的混合气体依次通过Na2O2和水之后,气体无剩余,则混合气体中NO与CO2的的分子个数比为 ( )
| A.1:1 | B.2:3 | C.3:2 | D.4:3 |
某氮肥NH4HCO3中混有少量(NH4)2CO3,现采用下列方案测定该氮肥中(NH4)2CO3的质量分数:称取5.7 g上述样品与2.0 mol/L NaOH溶液混合,完全溶解后,低温加热使其充分反应(该温度下铵盐不分解),并使生成的氨气全部被硫酸吸收,测得氨气的质量与所用NaOH溶液体积的关系如图所示: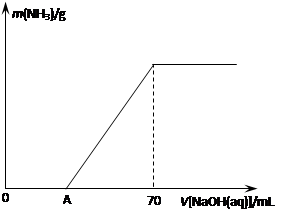
请回答下列问题:
⑴A点前样品与NaOH反应的离子方程式为 ▲ 。
⑵为使生成的氨气被硫酸吸收时不发生倒吸,可以选用下列装置中的 ▲ 。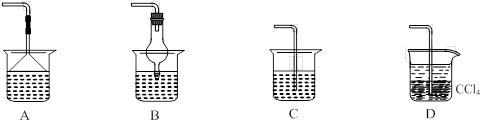
⑶样品中(NH4)2CO3的质量分数是 ▲ %(保留一位小数)。
⑷当V[NaOH(aq)]="50" mL时,生成NH3的质量为 ▲ 。
将盛有NO2和O2的混合气体的试管倒扣在水中,充分反应后,试管内充满溶液,则NO2和O2的体积比为
| A.1:1 | B.3:1 | C.4:3 | D.4:1 |
氨是一种重要的化工产品,其化学式为 ,具有 气味,密度比空气的 (填“大”或“小”), (填“易”或“难”)溶于水,因此,收集氨气应采用_______________法。