某无色溶液中只含有下列8种离子中的某几种:Mg2+、H+、Ag+、Na+、Cl-、HC 、OH-、N
、OH-、N ,已知该溶液能与铝反应放出氢气。试回答下列问题:
,已知该溶液能与铝反应放出氢气。试回答下列问题:
(1)若反应后生成Al3+,则溶液中可能存在的离子有 ,一定存在的离子有 ,一定不存在的离子有 ,反应的离子方程式为 。
(2)若反应后生成Al ,则溶液中可能存在的离子有 ,一定存在的离子有 ,一定不存在的离子有 ,反应的离子方程式为 。
,则溶液中可能存在的离子有 ,一定存在的离子有 ,一定不存在的离子有 ,反应的离子方程式为 。
下列是某无色水样成分的检验,已知该水样中只可能含K+、Mg2+、Fe3+、Cu2+、Ag+、Ca2+、C 、S
、S 、Cl-中的若干种离子,该小组同学取100 mL水样进行实验:向样品中先滴加硝酸钡溶液,再滴加1 mol·L-1硝酸,实验过程中沉淀质量的变化如下图所示:
、Cl-中的若干种离子,该小组同学取100 mL水样进行实验:向样品中先滴加硝酸钡溶液,再滴加1 mol·L-1硝酸,实验过程中沉淀质量的变化如下图所示:
(1)水样中一定含有的阴离子是 ,其物质的量浓度之比为 。
(2)写出BC段曲线所表示反应的离子方程式:
。
(3)由B点到C点变化过程中消耗硝酸的体积为 。
(4)试根据实验结果推测K+是否存在? (填“是”或“否”);若存在,K+的物质的量浓度c(K+)的范围是 (若K+不存在,则不必回答)。
(5)设计简单实验验证原水样中可能存在的离子:(写出实验步骤、现象和结论)
。
为防止环境污染和发生意外事故,实验过程中产生的废液不能随意倒入下水道。已知某次化学实验后,回收的废液中可能含有K+、Cu2+、Ag+等离子。
(1)为检验废水中是否含有Ag+,可以采用的试剂是 。如果溶液中确实存在Ag+,加入试剂后,将观察到的现象是
。
(2)实验证明,废液中确实存在上述三种离子。为回收Cu、Ag两种金属,实验时可以分别加入过量的 和 (填物质名称),充分反应后,经过 (填实验操作名称),可得到Cu和Ag。经过上述处理后的废水,进一步处理后即可以排放。
现有A、B、C、D、E、F六种化合物,已知它们的阳离子分别是K+、Ag+、Ca2+、Ba2+、Fe2+、Al3+,阴离子分别是Cl-、OH-、CH3COO-、NO3-、SO42-、CO32-,将它们分别配成0.1 mol/L的溶液,进行如下实验:
① 测得溶液A、C、E呈碱性,且碱性为A>E>C;
② 向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
③ 向D溶液中滴加Ba(NO3)2溶液,无明显现象;
④ 向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
根据上述实验现象,回答下列问题:
(1) 实验②中反应现象所涉及的离子方程式是__________ _____________
_________________________________________________ _____________________。
(2) E溶液中溶质的名称是______,判断依据是_________________________________。
(3) 写出下列四种化合物的化学式:
A:_______________ C:_____________ D:_______________ F:_______________
某待测溶液(阳离子为Na+)中可能含有SO42-、SO32-、NO3-、Cl-、Br-、CO32-、HCO3-中的一种或多种,进行如图所示的实验,每次实验所加试剂均过量,回答以下问题:
(1)待测液中是否含有SO42-、SO32-:_____________________ 。
(2)沉淀B的化学式为_________;生成沉淀B的离子方程式为
___________________ __。
(3)根据以上实验,待测液中肯定没有的离子是___________________; 肯定存在的离子还有________________________。
(1)现有A、B、C三种化合物,各取40g相混合,完全反应后,得18g B和49g C ,还有D生成。已知D的式量为106,现将22g A和11g B混合反应,能生成D mol。
(2)200mL某溶液中含有的离子及其物质的量如下:
| 离子 |
H+ |
K+ |
NO3- |
SO42- |
| 物质的量(mol) |
0.5 |
0.1 |
0.6 |
0.15 |
该溶液中还含有的离子一定是下列中的 (填序号),该离子的浓度为
A.Al3+ B.Cl- C ClO- D.Fe2+
(3)某学生往一支试管中按一定的顺序分别加入下列几种物质(一种物质只加一次):
A.KI溶液 B.淀粉溶液 C.NaOH溶液 D.稀H2SO4 E.氯水
发现溶液颜色按如下顺序变化:①无色→②棕黄色→③蓝色→④无色→⑤蓝色。依据溶液颜色的变化,回答下列问题:
(ⅰ)加入以上药品的顺序是(写序号) ____________________________________________。
(ⅱ)①→②反应的化学方程式为_______________________________________________。
(ⅲ)溶液由棕黄色变为蓝色的原因是___________________________________________。
(10分)某种溶液仅含下表离子中的5种(不考虑水的电离与离子水解),且各种离子的物质的量均为1 mol。
| 阳离子 |
K+ Ba2+ Fe2+ Al3+ Fe3+ Mg2+ |
| 阴离子 |
OH- HCO3- CO32- Cl- NO3- SO42- |
若向原溶液中加入足量的盐酸,有无色气体生成。经分析反应后溶液中阴离子的种类没有变化。
(1)溶液中______(填“一定”、“一定不”或“可能”)含有HCO3-或CO32-,理由是________________。
(2)原溶液中所含的阴离子为__________,阳离子为__________。
(3)向原溶液中加入足量的盐酸,有无色气体生成的离子反应方程式为__________________。
(4)若向原溶液中加入足量的氢氧化钠溶液,充分反应后将沉淀过滤、洗涤、干燥灼烧至恒重,得到固体质量为__________g。
(一)下列各组离子在指定溶液中一定能大量共存的是___________________。
①无色溶液中:K+、Na+、MnO 、SO
、SO
②甲基橙呈黄色的溶液中:I-、Cl-、NO 、Na+
、Na+
③石蕊呈蓝色的溶液中:Na+、AlO 、NO
、NO 、HCO
、HCO
④在pH=1的溶液中:Fe2+、NO 、SO
、SO 、Na+
、Na+
⑤在pH=0的溶液中:Na+、NO 、SO
、SO 、K+
、K+
⑥在pH=12的溶液中:K+、Cl-、HCO 、Na+
、Na+
⑦含大量OH-的溶液中:CO 、Cl-、F-、K+
、Cl-、F-、K+
⑧ =1012的溶液中:NH
=1012的溶液中:NH 、Al3+、NO
、Al3+、NO 、Cl-
、Cl-
⑨加入Al能放出H2的溶液中:Cl-、HCO 、SO
、SO 、NH
、NH
⑩由水电离出的c(OH-)=10-14 mol/L的溶液中:Ca2+、K+、Cl-、HCO
⑪c(Fe3+)=0.1 mol/L的溶液中:K+、ClO-、SO 、SCN-
、SCN-
⑫含大量Al3+的溶液中:K+、Na+、NO 、ClO-
、ClO-
(二)三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,请根据要求回答下列问题:
(1)反应过程中,被氧化与被还原的元素原子的物质的量之比为____________。
(2)写出该反应的化学方程式_____________________________________。
(3)NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现.你判断该气体泄漏时的现象是_______________________________________。
(4)一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO2、NaF、H2O外,还肯定有______________________________(填化学式)。
(14分)常见的五种盐A、B、C、D、E,它们的阳离子可能是Na+、NH 、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO
、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO 、SO
、SO 、CO
、CO 。已知:
。已知:
①五种盐均溶于水,水溶液均为无色。
②D的焰色反应呈黄色。
③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失。
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀。 回答下列问题:
(1)五种盐中,一定没有的阳离子是________;所含的阴离子相同的两种盐的化学式是________。
(2)D的化学式为________,D溶液显碱性的原因是(用离子方程式表示)_________________。
(3)A和C的溶液反应的离子方程式是_____________________。
E和氨水反应的离子方程式是_______________________。
(4)若要检验B中所含的阳离子,正确的实验方法是_____________________
(12分) (1)含氯消毒剂可防甲型H1N1流感。二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3在H2SO4存在下与Na2SO3反应制得。请写出反应的离子方程式___________________________________________。
(2)某无色溶液只含有下列8种离子中的某几种:Na+、H+、Mg2+、Ag+、Cl-、OH-、HCO 、NO
、NO 。已知该溶液可与Al2O3反应,则:
。已知该溶液可与Al2O3反应,则:
①该溶液与Al2O3反应后有Al3+生成,则原溶液中一定含有____,一定不会含有大量的________。
②该溶液与Al2O3反应后有AlO 生成,则原溶液中一定含有________,可能含有大量的________。
生成,则原溶液中一定含有________,可能含有大量的________。
③写出该溶液与Al2O3反应生成AlO 的离子方程式__________________________________。
的离子方程式__________________________________。
(10分)某混合物的水溶液,可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、CO32-、SO42-,现分别取100mL的两等份溶液进行如下实验:
①第一份加过量NaOH溶液后加热,收集到0.02mol气体,无沉淀生成,同时得到溶液甲。
②向甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧后,得到1.02g固体。
③第二份加足量BaCl2溶液后,生成白色沉淀,沉淀经足量盐酸洗涤、干燥后,得到11.65g固体。
依据实验回答下列问题:
(1)由①可知存在的离子为 ,浓度是 mol·L-1;由②可知存在的离子为 ,浓度是 mol·L-1;由③可知存在的离子为 ,浓度是 mol·L-1。
(2)该溶液中一定不存在的离子是 (填离子符号)。
(3)某同学通过分析认为该溶液中一定存在K+,他的理由是 。
Ⅰ (本题4分)赤铜矿的成分是Cu2O,辉铜矿的成分是Cu2S,将赤铜矿与辉铜矿混合物加热有以下反应发生:2Cu2O+Cu2S 6Cu+SO2↑; 填写下列空白:
6Cu+SO2↑; 填写下列空白:
①在该反应中,氧化剂是 。还原剂是 。
②氧化产物与还原产物的质量比是 。
Ⅱ(本题7分)A、B、C、D、E为易溶化合物,其离子组成为
| 阳离子 |
Fe3+、Ba2+、Al3+、Na+、Ag+ |
| 阴离子 |
NO3—、OH—、SO42—、Cl—、CO32— |
在各化合物中离子不重复,分别取其溶液进行实验,结果如下:
①在A溶液中逐滴加入氨水,有白色沉淀生成,继续加氨水至过量,沉淀消失;
②用pH试纸测得B和C溶液显碱性,0.1mol/L的C溶液pH小于13;
③在D溶液中加入铁粉,溶液质量增加且无气体产生;
④在E溶液中加入过量B,没有沉淀产生。
完成下列填空:
(1)A的化学式为 ; (2)③反应的离子方程式为 ;
(3)检验D溶液中阴离子的的方法是 ;
(4)E的的化学式为 ,将E蒸干、灼热至质量不再改变,最后所得物质是(填化学式) 。
某强酸性溶液X可能含有Ba2+、A13+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、C1-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下:根据以上信息,回答下列问题:
(1)气体F为____________。
(2)上述离子中,溶液X中除H+外还肯定含有的离子是_______,不能确定是否含有的离子是____。
(3)写出生成A的离子方程式:_________________。
(4)通常可以利用KClO在碱性条件下氧化G来制备一种新型、高效、多功能水处理剂K2FeO4.请写出制备过程中的离子方程式__________________。
某固体混合物可能由KNO3、K2SO4、KI、KCl、NaCl、CuCl2、CaCl2和Na2CO3中的一种或几种组成。依次进行下列五步实验,观察到的现象记录如下:
(1)混合物加水得无色透明溶液;
(2)向上述溶液中滴加BaCl2溶液,有白色沉淀生成。将该沉淀滤出,并将滤液分成两份;
(3)上述白色沉淀可完全溶于稀盐酸;
(4)将两份滤液中的一份,滴加氯水并加入CCl4,振荡后静置,CCl4层无色;
(5)将另一份滤液中加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀硝酸。
根据以上实验,可以判断出混合物中①肯定含有_______,②不能确定是否含有 _________,③一定不含有_______。
某强酸性溶液X可能含有Ba2+、Al3+、NH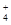 、Fe2+、Fe3+、CO
、Fe2+、Fe3+、CO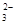 、SO
、SO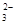 、SO
、SO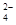 、Cl-、NO
、Cl-、NO 中的一种或几种,取该溶液进行连续实验,实验过程如下:
中的一种或几种,取该溶液进行连续实验,实验过程如下: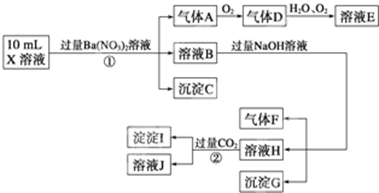
根据以上信息,回答下列问题:
(1)上述离子中,溶液X中除H+外还肯定含有的离子是______,不能确定是否含有的离子(M)是______,若要确定该M(若不止一种,可任选一种)在溶液X中不存在,最可靠的化学方法是______.
(2)写出反应②的离子方程式:______.
(3)通常可以利用KClO在一定条件下氧化G来制备一种新型、高效、多功能水处理剂K2FeO4.请写出制备过程中的离子方程式______.
(4)假设测定A、F、I均为0.1mol,10mL X溶液中n(H+)=0.4mol,当沉淀C物质的量大于0.7mol时,溶液X中还一定含有______.