下列溶液中各离子的浓度关系正确的是
| A.0.1 mol·L-1 CH3COONa溶液中:c(CH3COO-)+c(CH3COOH)="0.1" mol·L-1 |
| B.25℃时,等物质的量浓度的各溶液pH关系为: pH(Na2CO3)>pH(C6H5ONa)>pH(NaHCO3)>pH(CH3COONa) |
| C.25℃时,pH=9.4、浓度均为0.1 mol·L-1的HCN与NaCN的混合溶液中:c(Na+)>c(CN-)>c(HCN)>c(OH-) |
| D.将足量AgCl分别放入:①5m水,②10mL0.2mol/LMgC12,③20mL0.3mol/L盐酸中溶解至饱和,c(Ag+):①>②>③ |
下列溶液中有关粒子的物质的量浓度关系正确的是
A.氯水中:2c(Cl2)=c(ClO-)+c(Cl-)+c(HClO)
B.25℃时,pH=12的NaOH溶液与pH=12的氨水:c (Na+ ) = c(NH4+ )
C.pH=4的0.1 mol·L-1的NaHA溶液中:c (HA-) > c (H+ ) > c (H2A) > c (A2- )
D.在K2CO3溶液中:c (CO32- ) + c (OH- ) = c (HCO3- ) + c( H+ )
常温下,下列有关醋酸溶液的叙述中不正确的是( )
| A.pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO—) |
| B.浓度均为0.1mol/L的CH3COOH和CH3COONa溶液等体积混合后:c(CH3COO—)- c(CH3COOH)=2[c(H+)- c(OH—)] |
C.将pH=a的醋酸稀释为pH=a+1的过程中,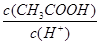 不变 不变 |
| D.0.2mol/L的CH3COOH溶液中c(H+)与0.1mol/LCH3COOH溶液中c(H+)的比值小于2 |
将20 mL 0.1 mol·L-1的氨水与10 mL 0.1 mol·L-1的盐酸混合,所得到的溶液中离子浓度的关系错误的是( )
| A.c(NH4+)+c(H+)=c(OH-)+c(Cl-) |
| B.c(NH4+)+c(NH3·H2O)=2c(Cl-) |
| C.2c(OH-)-2c(H+)=c(NH4+)-c(NH3·H2O) |
| D.c(H+)=c(NH3·H2O)+c(OH-) |
下列叙述正确的是
| A.NaHCO3溶液中存在: c(OH-) =c(H+)+c(H2CO3) |
| B.某二元弱酸强碱盐NaHA溶液中存在:c(Na+)+c(H+)=c(A2-)+c(HA-)+c(OH-) |
| C.CH3COONa和NaCl混合溶液中存在:c(Na+)=c(CH3COO-)+c(Cl-) |
| D.常温下,10mL 0.02mol·L-1 HCl溶液与10mL 0.01mol·L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=7 |
国家环境保护总局网公布了”141种高污染、高环境风险”的产品名录,包括43号氰化钠、46号氢氰酸、55号高氯酸铵、57号硫化钠等。下列说法不正确的是
A.已知常温下0.1  NaCN溶液的pH=12,则已水解的 NaCN溶液的pH=12,则已水解的 约占总数的10% 约占总数的10% |
B.已知25 ℃时 溶液显碱性,则25 ℃时的电离常数K 溶液显碱性,则25 ℃时的电离常数K K(HCN) K(HCN) |
C. 溶液中,c 溶液中,c c c c c c c |
D.欲使0.1   溶液中 溶液中 更接近2,可加入适量KOH 更接近2,可加入适量KOH |
下列溶液中各微粒的浓度关系不正确的是
| A.0.1 mol/LCH3COOH溶液中:c(CH3COO-)+c(CH3COOH)=0.1mol/L |
| B.NaHCO3溶液中: (OH-) = c(H+) +c(H2CO3)- c(CO32—) |
| C.CH3COONa溶液中:c(Na+)>c(CH3COO-)> (OH-)> c(CH3COOH)> c(H+) |
| D.Na2S溶液中:2c(Na+)= c(S2—) + c(HS—)+ c(H2S) |
常温下,取pH="2" 的两种二元酸H2A与H2B各1mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是
A.H2A为二元弱酸
B.稀释前c(H2B)>c(H2A)="0.01mol" /L
C.pH=3的NaHA水溶液中,离子浓度大小为c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-)
D.Na2B的水溶液中,离子浓度大小为c(Na+)>c(B2-)>c(OH-)>c(H+)
下列说法正确的是
| A.某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA-)+c(A2-) |
| B.一定量的(NH4)2SO4与NH3·H2O混合所得的酸性溶液中:c(NH)<2c(SO) |
| C.物质的量浓度均为0.01 mol·L-1的CH3COOH和CH3COONa的溶液等体积混合后溶液中c(CH3COOH)+c(CH3COO-)=0.02 mol·L-1 |
| D.物质的量浓度相等的①NH4HSO4溶液、②NH4HCO3溶液、③NH4Cl溶液中c(NH):①>②>③ |
在常温条件下,下列对醋酸的叙述中,不正确的是
| A.pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-) |
| B.将pH=a的醋酸稀释为pH=a+1的过程中,c(CH3COOH)/c(H+)变小 |
| C.浓度均为0.1 mol·L-1的CH3COOH和CH3COONa溶液等体积混合后: c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
| D.等体积pH=a的醋酸与pH=b的NaOH溶液恰好中和时,存在a+b=14 |
已知Fe2+结合S2-的能力大于结合OH-的能力,而Al3+则正好相反。在Fe2(SO4)3和AlCl3的混合溶液中,先加入过量的KI溶液,再加入足量的Na2S溶液,所得沉淀是
| A.Al2S3、FeS和S | B.Fe(OH)3和Al(OH)3 |
| C.Fe2S3和Al(OH)3 | D.FeS、Al(OH)3和S |
Na2CO3溶液中含碳元素微粒有多种,常温下,这些微粒的物质的量分数与溶液pH的变化关系如图所示。下列说法正确的是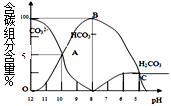
| A.在滴有酚酞的Na2CO3溶液中逐渐滴加盐酸至溶液恰好变为无色,得到NaHCO3溶液 |
| B.有CO2气体放出的范围是pH≤5 |
| C.HCO3-的电离平衡常数为1×10-4 |
| D.pH=11的Na2CO3溶液稀释到体积为原来的100倍后pH=9 |
常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液,整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是
| A.实验进程中可用pH试纸测定溶液的pH |
| B.a点的溶液中:c(H+)=c(Cl-)+c(HClO)+c(OH-) |
| C.c点所示溶液中:c(Na+)=2c(ClO-)+c(HClO) |
D.由a点到b点的过程中,溶液中 减小 减小 |
下列说法正确的是
| A.在pH等于2的醋酸溶液中加入少量0.01 mol•L﹣1的稀盐酸,溶液的pH会变小 |
| B.等物质的量浓度的碳酸钠溶液与碳酸氢钠溶液混合,混合溶液中c(CO32-) 一定小于c(HCO3-) |
| C.等浓度的CH3COOH和CH3COONa溶液按体积比2:1混合后的溶液中:2C(CH3COO-)+3c(OH-)=3c(H+)+C(CH3COOH) |
| D.常温下,在50.00mLpH=b的NaOH溶液中滴入11.11mL pH=a的盐酸时,溶液pH变为2,则此NaOH溶液的pH为11(已知a+b=13,混合后溶液体积为61.11mL) |