咖啡因是一种生物碱(易溶于水及乙醇,熔点234.5℃,100℃以上开始升华),有兴奋大脑神经和利尿等作用。茶叶中含咖啡因约1%~5%、单宁酸(K a约为10 −4, 易溶于水及乙醇)约3%~10%,还含有色素、纤维素等。实验室从茶叶中提取咖啡因的流程如下图所示。
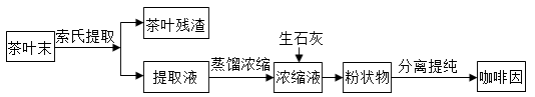
索氏提取装置如图所示。实验时烧瓶中溶剂受热蒸发,蒸汽沿蒸汽导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,与茶叶末接触,进行萃取。萃取液液面达到虹吸管3顶端时,经虹吸管3返回烧瓶,从而实现对茶叶末的连续萃取。回答下列问题:
(1)实验时需将茶叶研细,放入滤纸套筒1中,研细的目的是________,圆底烧瓶中加入95%乙醇为溶剂,加热前还要加几粒________。
(2)提取过程不可选用明火直接加热,原因是________,与常规的萃取相比,采用索氏提取器的优点是________。
(3)提取液需经"蒸馏浓缩"除去大部分溶剂,与水相比,乙醇作为萃取剂的优点是________。"蒸发浓缩"需选用的仪器除了圆底烧瓶、蒸馏头、温度计、接收管之外,还有________(填标号)。
A.直形冷凝管 B.球形冷凝管C.接收瓶D.烧杯
(4)浓缩液加生石灰的作用是________ 和吸收________
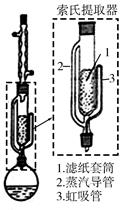
(5)可采用如图所示的简易装置分离提纯咖啡因。将粉状物放入蒸发皿中并小火加热,咖啡因在扎有小孔的滤纸上凝结,该分离提纯方法的名称是________。
三氯氢硅(
)是制备硅烷、多晶硅的重要原料。回答下列问题:
(1) 在常温常压下为易挥发的无色透明液体,遇潮气时发烟生成 等,写出该反应的化学方程式________。
(2) 在催化剂作用下发生反应:
则反应 的 ________ 。
(3)对于反应 ,采用大孔弱碱性阴离子交换树脂催化剂,在 和 时 的转化率随时间变化的结果如图所示。
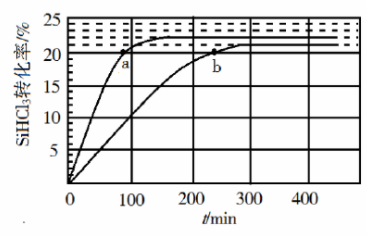
① 时反应的平衡转化率 α=________%。平衡常数 ________(保留2位小数)。
②在 下:要提高 转化率,可采取的措施是________;要缩短反应达到平衡的时间,可采取的措施有________、________。
③比较a、b处反应速率大小: ________ (填"大于""小于"或"等于")。反应速率 − , 、 分别为正、逆向反应速率常数, x为物质的量分数,计算a处 =________(保留1位小数)。
CO2/HCOOH循环在氢能的贮存/释放、燃料电池等方面具有重要应用。
(1)CO2催化加氢。在密闭容器中,向含有催化剂的KHCO3溶液(CO2与KOH溶液反应制得)中通入H2生成HCOO﹣,其离子方程式为 ;其他条件不变,HCO3﹣转化为HCOO﹣的转化率随温度的变化如图1所示。反应温度在40℃~80℃范围内,HCO3﹣催化加氢的转化率迅速上升,其主要原因是 。

(2)HCOOH燃料电池。研究HCOOH燃料电池性能的装置如图2所示,两电极区间用允许K+、H+通过的半透膜隔开。
①电池负极电极反应式为 ;放电过程中需补充的物质A为 (填化学式)。
②如图2所示的HCOOH燃料电池放电的本质是通过HCOOH与O2的反应,将化学能转化为电能,其反应的离子方程式为 。
(3)HCOOH催化释氢。在催化剂作用下,HCOOH分解生成CO2和H2可能的反应机理如图3所示。
①HCOOD催化释氢反应除生成CO2外,还生成 (填化学式)。
②研究发现:其他条件不变时,以HCOOK溶液代替HCOOH催化释氢的效果更佳,其具体优点是 。
实验室由炼钢污泥(简称铁泥,主要成分为铁的氧化物)制备软磁性材料α﹣Fe2O3.其主要实验流程如图。

(1)酸浸。用一定浓度的H2SO4溶液浸取铁泥中的铁元素。若其他条件不变,实验中采取下列措施能提高铁元素浸出率的有 (填序号)。
A.适当升高酸浸温度
B.适当加快搅拌速度
C.适当缩短酸浸时间
(2)还原。向“酸浸”后的滤液中加入过量铁粉,使Fe3+完全转化为Fe2+.“还原”过程中除生成Fe2+外,还会生成 (填化学式);检验Fe3+是否还原完全的实验操作是 。
(3)除杂。向“还原”后的滤液中加入NH4F溶液,使Ca2+转化为CaF2沉淀除去。若溶液的pH偏低,将会导致CaF2沉淀不完全,其原因是 [Ksp(CaF2)=5.3×10﹣9,Ka(HF)=6.3×10﹣4]。
(4)沉铁。将提纯后的FeSO4溶液与氨水﹣NH4HCO3混合溶液反应。生成FeCO3沉淀。
①生成FeCO3沉淀的离子方程式为 。
②设计以FeSO4溶液、氨水﹣NH4HCO3混合溶液为原料,制备FeCO3的实验方案: [FeCO3沉淀需“洗涤完全”,Fe(OH)2开始沉淀的pH=6.5]。