已知:①硫酸比次氯酸稳定;②高氯酸是比硫酸更强的酸;③S2﹣易被氯气氧化;④氯化氢比硫化氢稳定;⑤稀盐酸不跟铜反应,浓硫酸能跟铜反应。上述叙述中可说明氯元素比硫元素非金属性强的是( )
| A.①②③ | B.②③④ | C.③④⑤ | D.①③⑤ |
氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与Br2+SO2+2H2O=H2SO4+2HBr相比较,水的作用不相同的是( )
| A.2Al+2NaOH+2H2O=2NaAlO2+3H2↑ |
| B.CaC2 + 2H2O→CH≡CH↑+ Ca(OH)2 |
| C.4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
| D.2Na2O2+2H2O=4NaOH+O2↑ |
常温下,在下列溶液中发生如下反应: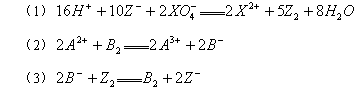
由此判断,下列说法错误的是
A.溶液中不可能发生反应 |
| B.Z2元素在(1)(3)反应中均做还原剂 |
C.氧化性由强到弱顺序是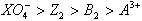 |
| D.X2+是XO4还原产物 |
已知有如下反应:①2BrO3-+Cl2==Br2+2ClO3-,②2FeCl2+Cl2==2FeCl3 ③ClO3-+5Cl-+6H+==3Cl2+3H2O,④2FeCl3+2KI==2FeCl2+2KCl+I2,下列各微粒氧化能力由强到弱的顺序正确的是 ( )
| A.ClO3- > BrO3- > Cl2 > Fe3+ > I2 | B.BrO3- > Cl 2> ClO3- > I2 > Fe3+ |
| C.BrO3- > ClO3- > Cl2 > Fe3+ > I2 | D.BrO3- > ClO3- > Fe3+ > Cl2 >I2 |
根据下列反应判断有关物质还原性由强到弱的顺序是
H2SO3+I2+H2O===2HI+H2SO4
2FeCl3+2HI===2FeCl2+2HCl+I2
3FeCl2+4HNO3===2FeCl3+NO↑+2H2O+Fe(NO3)3
| A.H2SO3>I->Fe2+>NO | B.I->Fe2+>H2SO3>NO |
| C.Fe2+>I->H2SO3>NO | D.NO>Fe2+>H2SO3>I- |
从海水中提取溴,主要反应为:2Br-+Cl2=Br2+2Cl-,下列说法不正确的是( )
| A.溴离子具有氧化性 | B.氯气是还原剂 |
| C.该反应属于复分解反应 | D.氯气的氧化性比溴单质强 |
已知反应3Cl2 + 6NaOH="5NaCl" + NaClO3 + 3H2O下列说法正确的是 ( )
| A.NaCl是氧化产物,NaClO3是还原产物 | B.该反应中的电子转移数目为6e- |
| C.氧化剂和还原剂的质量比是1:5 | D.Cl2既是氧化剂也是还原剂 |
氧化还原是常见的反应类型,根据信息回答以下问题: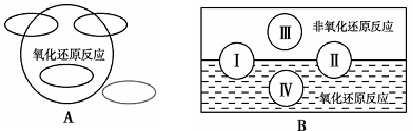
1、A图是“四种基本反应类型与氧化还原反应的关系”图,请在A图中用阴影部分表示反应:Cl2 + 2NaBr —→ 2NaCl + Br2 所属的区域。
2、“四种基本反应类型与氧化还原反应的关系”也可用B图表达。①其中Ⅰ为化合反应,则Ⅱ为 反应。②写出一个有水生成的符合反应类型Ⅲ的化学方程式: 。③写出一个有水参加的符合反应类型Ⅳ的化学方程式 ,
其中水作为 剂。(填氧化剂、还原剂等)
3、用“单线桥”分析下列氧化还原反应的电子转移方向及数目,并填空。
(1)2HClO —光→ 2HCl + O2↑ 氧化产物 被还原的元素
(2)2NaCl + 2H2O —电解→ 2NaOH + Cl2↑ + H2↑
4、有F-、Cl-、I-、Br2、I2五种粒子,其中氧化性最强的是 ,还原性最强的是 ,用离子方程式表示氧化性强弱的事实:
。
甲、乙两种非元素:①甲比乙容易与H2化合;②甲原子能与乙的阴离子发生置换反应;③甲的最高价氧化物对应的水化物酸性比乙的最高价氧化物对应的水化物酸性强;④与某金属反应时,甲原子得电子数目比乙的多;⑤甲的单质熔、沸点比乙的低。能说明甲比乙的非金属性强的是( )
| A.只有④ | B.只有⑤ | C.①②③ | D.①②③④⑤ |
在3BrF3+5H2O=Br2+HBrO3+O2↑+9HF的化学反应中,若有10.8g水被氧化,则被水还原的BrF3的物质的量是()
| A.0.24mol | B.0.36mol | C.0.40mol | D.0.60mol |
在反应 3S + 6NaOH  2Na2S + Na2SO3 + 3H2O 中被氧化的硫与被还原的硫的关系是 ( )
2Na2S + Na2SO3 + 3H2O 中被氧化的硫与被还原的硫的关系是 ( )
| A.物质的量之比为2∶1 | B.质量比为2∶1 |
| C.质量比为 1∶2 | D.物质的量之比为1∶1 |
根据反应式:①2Fe3+ + 2I- = 2Fe2+ + I2 ②Br2 + 2Fe2+ ="==" 2Fe3+ +2Br-,可判断离子的还原性从强到弱的顺序是
| A.Br-、Fe2+、I- | B.I-、Fe2+、Br- |
| C.Br-、I-、Fe2+ | D.Fe2+、I-、Br- |
氢化钠(NaH)是一种生氢剂,可发生如下反应:NaH+H2O = NaOH+H2↑对这一反应的描述正确的是( )
| A.NaH是氧化剂 | B.NaH是氧化产物 |
| C.NaOH是还原产物 | D.氧化产物与还原产物的质量比是1:1 |
氢化钙可以作为生氢剂(其中CaH2中氢元素为-1价),反应方程式如下:CaH2+2H2O=Ca(OH)2+2H2↑,其中水的作用是( )
| A.既不是氧化剂也不是还原剂 | B.是氧化剂 |
| C.是还原剂 | D.既是氧化剂又是还原剂 |