据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。
其电池反应为:2CH3OH + 3O2 + 4OH— = 2CO32—+ 6H2O,则下列说法错误的( )
| A.放电时CH3OH参与反应的电极为正极 |
| B.充电时电解质溶液的pH逐渐增大 |
| C.放电时负极的电极反应为:2CH3OH-12e-+16OH-2CO32—+ 12H2O |
| D.充电时每生成1 mol CH3OH转移6 mol电子 |
根据右图,下列判断中正确的是
| A.向烧杯a中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成 |
| B.烧杯b中发生反应为2Zn-4eˉ =2Zn2+ |
| C.电子从Zn极流出,流入Fe极,经盐桥回到Zn极 |
| D.烧杯a中发生反应O2 + 4H++ 4eˉ = 2H2O,溶液pH降低 |
燃料电池具有能量转化率高无污染等特点,下图为Mg—NaClO燃料电池结构示意图。下列说法正确的是( )

| A.镁作Y电极 |
| B.电池工作时Na+向负极移动 |
| C.废液的pH大于NaClO溶液的pH |
D. X电极上发生的反应为: |
下图是氢氧燃料电池(电解质溶液为H3PO4溶液)构造示意图。关于该电池的说法不正确的是( )
| A.a极是负极 |
| B.正极的电极反应是:O2+2H2O+4e-=4OH- |
| C.电子由a通过灯泡流向b |
| D.氢氧燃料电池是环保电池 |
可以将氧化还原反应2H2+O2===2H2O设计成原电池。
(1)利用氢气和氧气、氢氧化钾溶液构成燃料电池,则负极通入的气体应是________,正极通入的气体就是________,电极反应式为:正极________________,负极________________。
(2)如把KOH改为稀硫酸做电解质,则电极反应式为:正极 ,负极__________________________。
(3)(1)和(2)的电解溶液不同,反应进行后,其溶液的pH各有何变化? 。
(4)如把H2改为甲烷,KOH溶液做电解质溶液,则电极反应式为:正极____________________________,负极________________________________。
用惰性电极分别电解下列各物质的水溶液,一段时间后,向剩余电解质溶液中加入适量相应的溶质能使溶液恢复到电解前浓度的是()
| A.AgNO3 | B.Na2SO4 | C.CuCl2 | D.KCl】 |
为体现“城市让生活更美好”的主题,上海市政府承诺世博园区内交通“零排放”、园区周边交通“低排放”。2010年4月15日新能源车交车仪式在世博园举行,该车装着“绿色心脏”——质子交换膜燃料电池,其工作原理如图所示,下列叙述正确的是( )
| A.通入氧气的电极发生氧化反应 |
| B.通入氢气的电极为正极 |
C.总反应式为O2+2H2 2H2O 2H2O |
| D.正极的电极反应式为O2+4H++4e-===2H2O |
下图是一种航天器能量储存系统原理示意图。下列说法正确的是
| A.该系统中只存在3种形式的能量转化 |
| B.装置Y中负极的电极反应式为O2+2H2O+4e-===4OH- |
| C.装置X能实现燃料电池的燃料和氧化剂再生 |
| D.装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化 |
镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:
Cd + 2NiOOH + 2H2O Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
A.放电时正极反应:NiOOH + H2O- e— ="=" Ni(OH)2 + OH-
B.充电过程是化学能转化为电能的过程
C 放电时Cd是负极,发生氧化反应
D.放电时电解质溶液中的OH-向正极移动
有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成原电池。电池的总反应类似于CH4在O2中燃烧,则下列说法不正确的是 ( )
①在标准状况下,每消耗5.6L CH4可以向外电路提供2mole-
②通过甲烷电极的电极反应式为:CH4+10OH--8e-=CO32-+7H2O
③通过甲烷的电极为电池的正极,通过氧气的电极为负极
④电池放电后,溶液PH不断升高
| A.①② | B.①③ | C.①④ | D.③④ |
一种新型熔融盐燃料电池具有高发电效率。现用Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极通O2和CO2混合气体,其总反应为:2CO+O2===2CO2。则下列说法中正确的是 ( )
| A.通CO的一极是电池的正极 |
B.负极发生的电极反应是:O2+2CO2+4e-―→2CO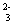 |
C.负极发生的电极反应是:CO+CO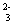 -2e-―→2CO2 -2e-―→2CO2 |
| D.正极发生氧化反应 |
氢氧燃料电池是一种高效、环境友好的发电装置,它是以铂作电极,KOH溶液作电解液,总反应为:2H2 + O2 = 2H2O,正极反应为:O2 + 2H2O + 4e- = 4OH- 下列叙述不正确的是
| A.H2通入负极区 | B.O2通入正极区 |
| C.负极发生氧化反应 | D.正极发生氧化反应 |
下列关于充电电池的叙述,不正确的是( )
| A.充电电池的化学反应原理是氧化还原反应 |
| B.充电电池可以无限制地反复放电、充电 |
| C.充电时的反应与放电时的反应相互可逆 |
| D.较长时间不使用用电器时,最好将电池取出,并妥善存放 |