铅蓄电池的两极分别为Pb、PbO2,电解液为硫酸,工作时的反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O,下面结论正确的是( )。
| A.Pb为正极,被氧化 |
| B.溶液的pH不断减小 |
C.S 只向PbO2处移动 只向PbO2处移动 |
| D.电解液密度不断减小 |
关于化学电源的叙述,错误的是( )。
| A.化学电源均是根据原电池的工作原理设计的 |
| B.在干电池中,碳棒只起导电作用,并不参加化学反应 |
| C.镍镉电池不能随意丢弃的主要原因是镍、镉的资源有限,价格昂贵 |
| D.燃料电池是一种高效、环保的新型化学电源 |
随着人们生活质量的不断提高,废电池进行集中处理的问题被提到议事日程,其首要原因是( )。
| A.利用电池外壳的金属材料 |
| B.防止电池中汞、镉和铅等金属离子对土壤和水源的污染 |
| C.不使电池中渗泄的电解液腐蚀其他的物品 |
| D.回收其中的石墨电极 |
下列关于充电电池的叙述,不正确的是( )。
| A.充电电池的化学反应原理是氧化还原反应 |
| B.充电电池可以无限制的充电放电 |
| C.充电是使放电时的氧化还原反应逆向进行 |
| D.较长时间不使用电池时,最好将电池取出并妥善存放 |
已知化学能与其他形式的能可以相互转化。填写下表的空白:
| 化学反应方程式(例子) |
能量转化形式 |
| ① |
由化学能转化为热能 |
②Pb+PbO2+2H2SO4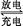 2PbSO4+2H2O 2PbSO4+2H2O |
|
③CaCO3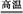 CaO+CO2↑ CaO+CO2↑ |
|
上述反应中属于氧化还原反应的是(填序号) 。
以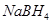 (B元素的化合价为+3)和
(B元素的化合价为+3)和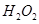 为原料的电池,可以作为通讯卫星的高能电池。其电极负极材料为Pt/C,正极材料为
为原料的电池,可以作为通讯卫星的高能电池。其电极负极材料为Pt/C,正极材料为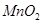 ,工作原理如图所示。下列说法不正确的是
,工作原理如图所示。下列说法不正确的是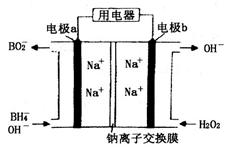
| A.该电池工作时Na+由a极区移向b极区 |
| B.电极b是原电池的正极 |
C.该电池的负极反应为: = = |
D.电路中通过6.02×1022个电子时,理论上消耗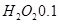 mol mol |
LiFePO4新型锂离子电池因其原材料丰富、对环境友好、循环性能和安全性能好的特点,具有广阔的应用前景。已知该电池放电时的电极反应式为:
正极:FePO4+Li++e-=LiFePO4,负极:Li-e-=Li+,下列说法中正确的是
| A.充电时阳极反应为Li++e-=Li |
| B.充电时动力电池上标注“-”的电极应与外接电源的负极相连 |
| C.放电时电池内部Li+向负极移动 |
| D.放电时,在正极上是Li+得电子被还原 |
某新型电池,以NaBH4(B的化合价为+3)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示。下列说法正确的是 ( )
| A.电池工作时Na+从b极区移向a极区 |
| B.每消耗3 mol H2O2,转移3 mol e- |
| C.b极上的电极反应式为:H2O2+2e-+2H+=2H2O |
| D.a极上的电极反应式为:BH4—+8OH--8e-=BO2—+6H2O |
电池是人类生产和生活中的重要能量来源,各式各样电池的发展是化学对人类的一项重大贡献。下列有关电池的叙述正确的是 ( )
| A.锌锰干电池工作一段时间后碳棒变细 |
| B.氢氧燃料电池可将热能直接转变为电能 |
| C.氢氧燃料电池工作时氢气在负极被氧化 |
| D.太阳能电池的主要材料是高纯度的二氧化硅 |
单质硅是很重要的工业产品。
(1)硅用于冶炼镁,也称硅热法炼镁。根据下列条件:
Mg(s)+ 1/2O2(g)= MgO(s) △H1=-601.8 kJ/mol
Mg(s)= Mg(g) △H2=+75 kJ/mol
Si(s) + O2(g) = SiO2(s) △H3= -859.4 kJ/mol
则2MgO(s)+ Si(s)= SiO2(s)+ 2Mg(g) △H =
Mg-NiOOH水激活电池是鱼雷的常用电池,电池总反应是:Mg+2NiOOH+2H2O=Mg(OH)2+ 2Ni(OH)2,写出电池正极的电极反应式 。
(2)制备多晶硅(硅单质的一种)的副产物主要是SiCl4,SiCl4对环境污染很大,遇水强烈水解,放出大量的热。研究人员利用SiCl4和钡矿粉(主要成分为BaCO3,且含有Fe3+、Mg2+等离子)制备BaCl2·2H2O和SiO2等物质。工艺流程如下: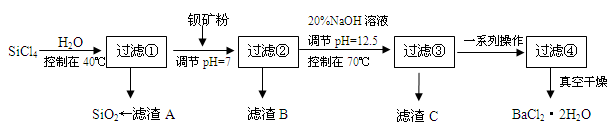
已知: 25℃ Ksp[Fe(OH)3]=4.0×10-38, Ksp[Mg(OH)2]=1.8×10-11;通常认为残留在溶液中的离子浓度小于1×10-5mol/L时,沉淀就达完全。回答下列问题:
①SiCl4发生水解反应的化学方程式为_______________________________________。
②若加钡矿粉调节pH=3时,溶液中c(Fe3+)= 。
③若用10吨含78% BaCO3的钡矿粉,最终得到8.4吨BaCl2·2H2O (M=244g/mol),则产率为 。
④滤渣C能分别溶于浓度均为3mol/L的 溶液和
溶液和 溶液(中性)。请结合平衡原理和必要的文字解释滤渣C能溶于3mol/L的
溶液(中性)。请结合平衡原理和必要的文字解释滤渣C能溶于3mol/L的 溶液的原因______。
溶液的原因______。
汽车等机动车辆的启动电源常用铅蓄电池,放电时的电池反应如下:
PbO2+Pb+2H2SO4=2PbSO4+2H2O,根据此反应判断下列叙述中正确的是
| A.Pb02是电池的负极 |
| B.负极的电极反应式为:Pb+SO42--2e-=PbSO4 |
| C.PbO2得电子,被氧化 |
| D.电池放电时,溶液酸性增强 |
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液(滴有几滴酚酞)电解实验,如图所示。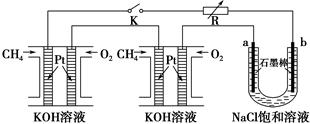
回答下列问题:
(1)甲烷燃料电池正极、负极的电极反应分别为________________________ 、________________________。
(2)闭合K开关后,a、b电极上均有气体产生,其中a电极上得到的是________;电解过程中________极(填“a”或“b”)附近会出现红色。电解氯化钠溶液的总化学方程式为________________________。将a、b两极的产物相互反应可得到“84”消毒液的有效成分NaClO,特殊情况下可用“84”消毒液吸收SO2,反应的离子方程式为________________________。
(3)若每个电池甲烷通入量为1 L(标准状况),且反应完全,则理论上最多能产生的氯气体积为________L(标准状况)。
关于铅蓄电池的说法正确的是 ( )。
| A.在放电时,正极发生的反应是Pb(s)+SO42-(aq)-2e-=PbSO4(s) |
| B.在放电时,该电池的负极材料是铅板 |
| C.在充电时,电池中硫酸的浓度不断变小 |
| D.在充电时,阳极发生的反应是PbSO4(s)+2e-=Pb(s)+SO42-(aq) |
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素原子的L层电子数为________;
(2)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)=N2O4(l) ΔH1=-19.5 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=-534.2 kJ·mol-1
写出肼和N2O4反应的热化学方程式________________________;
(3)已知H2O(l)=H2O(g) ΔH3=+44 kJ·mol-1,则表示肼燃烧热的热化学方程式为________________________。
(4)肼—空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为________________________。
新型锂离子电池材料Li2MSiO4(M为Fe,Co,Mn,Cu等)是一种发展潜力很大的电池电极材料。工业制备Li2MSiO4有两种方法。
方法一:固相法,2Li2SiO3+FeSO4 Li2FeSiO4+Li2SO4+SiO2。
Li2FeSiO4+Li2SO4+SiO2。
方法二:溶胶-凝胶法,CH3COOLi、Fe(NO3)3、Si(OC2H5)4等试剂 胶体
胶体 干凝胶
干凝胶 Li2FeSiO4。
Li2FeSiO4。
(1)固相法中制备Li2FeSiO4过程采用惰性气体气氛,其原因是
______________________________________________________________________。
(2)溶胶凝胶法中,检查溶液中有胶体生成的方法是________;生产中,生成1 mol Li2FeSiO4整个过程转移电子的物质的量为________mol。
(3)以Li2FeSiO4和嵌有Li的石墨为电极材料,含锂的导电固体作电解质,构成电池的总反应式为Li+LiFeSiO4 Li2FeSiO4,则该电池的负极是________;充电时,阳极反应的电极反应式为________。
Li2FeSiO4,则该电池的负极是________;充电时,阳极反应的电极反应式为________。
(4)使用(3)组装的电池必须先________。