高考化学苏教版总复习 6-2 原电池、常见的化学电源练习卷
电池是人类生产和生活中的重要能量来源,各式各样电池的发展是化学对人类的一项重大贡献。下列有关电池的叙述正确的是 ( )
| A.锌锰干电池工作一段时间后碳棒变细 |
| B.氢氧燃料电池可将热能直接转变为电能 |
| C.氢氧燃料电池工作时氢气在负极被氧化 |
| D.太阳能电池的主要材料是高纯度的二氧化硅 |
用吸附了氢气的碳纳米管等材料制作的二次电池的原理如图所示。下列说法正确的是 ( )
| A.放电时,负极的电极反应式为H2-2e-+2OH-=2H2O |
| B.充电时,阳极的电极反应式为Ni(OH)2+OH--e-=NiO(OH)+H2O |
| C.放电时,OH-移向镍电极 |
| D.充电时,将电池的碳电极与外电源的正极相连 |
某新型电池,以NaBH4(B的化合价为+3)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示。下列说法正确的是 ( )
| A.电池工作时Na+从b极区移向a极区 |
| B.每消耗3 mol H2O2,转移3 mol e- |
| C.b极上的电极反应式为:H2O2+2e-+2H+=2H2O |
| D.a极上的电极反应式为:BH4—+8OH--8e-=BO2—+6H2O |
如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是 ( )

| A.①②③ | B.②④ | C.④⑤⑥ | D.③④⑤ |
下图是一种染料敏化太阳能电池的示意图。电池的一个电极由有机光敏染料(S)涂覆在TiO2纳米晶体表面制成,另一电极由导电玻璃镀铂构成,电池中发生的反应为:
TiO2/S TiO2/S*(激发态)
TiO2/S*(激发态)
TiO2/S*―→TiO2/S++e-
I3—+2e-―→3I-
2TiO2/S++3I-―→2TiO2/S+I3—
下列关于该电池叙述错误的是 ( )
| A.电池工作时,I-在镀铂导电玻璃电极上放电 |
| B.电池工作时,是将太阳能转化为电能 |
| C.电池的电解质溶液中I-和I3—的浓度不会减少 |
| D.电池中镀铂导电玻璃为正极 |
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱作电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月。其电池反应为:2CH3OH+3O2+4OH- 2CO32—+6H2O,则下列说法正确的是( )
2CO32—+6H2O,则下列说法正确的是( )
| A.放电时CH3OH参与反应的电极为正极 |
| B.放电时负极的电极反应为CH3OH+8OH--6e-=CO32—+6H2O |
| C.标准状况下,通入5.6 L O2并完全反应后,有0.5 mol电子转移 |
| D.放电一段时间后,通入氧气的电极附近溶液的pH降低 |
控制适合的条件,将反应Fe3++Ag Fe2++Ag+设计成如图所示的原电池。下列判断不正确的是 ( )
Fe2++Ag+设计成如图所示的原电池。下列判断不正确的是 ( )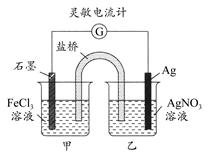
| A.反应开始时,石墨棒作阳极,银棒作阴极 |
| B.灵敏电流计的读数由小变大,再变小 |
| C.反应达化学平衡时,电流计读数最小 |
| D.反应达化学平衡时,在乙烧杯中滴入一定量的NaCl溶液,电流计指针又将偏转 |
下列有关电化学知识的描述正确的是 ( )
| A.CaO+H2O=Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池,把其中的化学能转化为电能 |
| B.某原电池反应为Cu+2AgNO3=Cu(NO3)2+2Ag,装置中的盐桥中可以是装有含琼胶的KCl饱和溶液 |
| C.因为铁的活泼性强于铜,所以将铁、铜用导线连接后放入浓硝酸中,若能组成原电池,必是铁作负极,铜作正极 |
| D.理论上说,任何能自发进行的氧化还原反应都可设计成原电池 |
实验发现,298 K时,在FeCl3酸性溶液中加入少量锌粒后,Fe3+立即被还原成Fe2+。某化学兴趣小组根据该实验事实设计了如图所示的原电池装置。下列有关说法中正确的是 ( )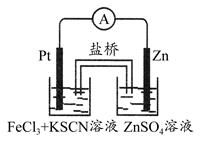
| A.该原电池的正极反应是:Zn-2e-=Zn2+ |
| B.左烧杯中溶液的红色逐渐褪去 |
| C.该电池铂电极上有气泡出现 |
| D.该电池总反应为:3Zn+2Fe3+=2Fe+3Zn2+ |
高功率Ni/MH(M表示储氢合金)电池已经用于混合动力汽车。总反应方程式如下:
Ni(OH)2+M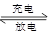 NiOOH+MH,下列叙述正确的是 ( )
NiOOH+MH,下列叙述正确的是 ( )
| A.放电时正极附近溶液的碱性增强 |
| B.放电时负极反应为:M+H2O+e-=MH+OH- |
| C.充电时阳极反应为:NiOOH+H2O+e-=Ni(OH)2+OH- |
| D.放电时每转移1 mol电子,正极有1 mol NiOOH被氧化 |
某锂电池的电池总反应为4Li+2SOCl2=4LiCl+S+SO2,下列有关说法正确的是 ( )
| A.锂电极作电池负极,放电过程中发生还原反应 |
| B.1 mol SOCl2发生电极反应转移的电子数为4 mol |
| C.电池的正极反应为2SOCl2+2e-=4Cl-+S+SO2 |
| D.组装该电池必须在无水、无氧的条件下进行 |
下图甲和乙是双液原电池装置。由图可判断下列说法错误的是( )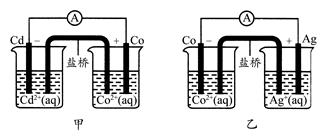
| A.甲图电池反应的离子方程式为:Cd(s)+Co2+(aq)=Co(s)+Cd2+(aq) |
| B.2Ag(s)+Cd2+(aq)=Cd(s)+2Ag+(aq)反应能够发生 |
| C.盐桥的作用是形成闭合回路,并使两边溶液保持电中性 |
| D.乙图当有1 mol电子通过外电路时,正极有108 g Ag析出 |
某原电池装置中盛有浓KOH溶液,若分别向__________(填“正”或“负”,下同)极通入可燃性气体,向__________极通入O2,则电路中就有电流通过,电流方向由__________极流向__________极,溶液中OH-向__________极移动。试完成下列问题:
| |
可燃性气体 |
正极反应 |
负极反应 |
电池总反应 |
pH变化 |
| (1) |
H2 |
|
|
|
|
| (2) |
CO |
|
|
|
|
| (3) |
CH4 |
|
|
|
根据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示,其中盐桥为琼胶饱和KNO3盐桥。请回答下列问题。 ( )
(1)电极X的材料是________,电解质溶液Y是________。
(2)银电极为电池的________极,写出两电极的电极反应式:
银电极:_________________________________________________;
X电极:___________________________________________________。
(3)外电路中,电子是从________电极流向________电极。
某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1 mol·L-1,盐桥中装有饱和K2SO4溶液。回答下列问题:
(1)发生氧化反应的烧杯是________(填“甲”或“乙”)。
(2)外电路的电流方向为:从________到________。(填“a”或“b”)
(3)电池工作时,盐桥中的SO42—移向________(填“甲”或“乙”)烧杯。
(4)甲烧杯中发生的电极反应为______________________________。
某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的开关K时,观察到电流计的指针发生了偏转。
请回答下列问题:
(1)甲、乙、丙三池中为原电池的是__________(填“甲池”、“乙池”或“丙池”)。
(2)丙池中F电极为__________(填“正极”、“负极”、“阴极”或“阳极”),该池的总反应式为__________。
(3)当乙池中C电极质量减轻10.8 g时,甲池中B电极理论上消耗O2的体积为__________mL(标准状况)。
(4)一段时间后,断开开关K。下列物质能使丙池恢复到反应前浓度的是__________(填选项字母)。
| A.Cu | B.CuO | C.CuCO3 | D.Cu2(OH)2CO3 |
 粤公网安备 44130202000953号
粤公网安备 44130202000953号