铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:
Pb+PbO2+4H++2SO42- 2PbSO4+2H2O
2PbSO4+2H2O

回答下列问题(不考虑氢、氧的氧化还原)
(1)放电时:正极的电极反应式是 ;电解液中H2SO4的浓度将变______,当外电路通过1mol电子时,理论上负极板的质量增加 g。
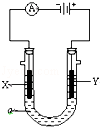
(2)在完全放电耗尽PbO2和Pb时,若按下图连接,电解一段时间后,则在A电极上生成__________,B电极上生成________,此时铅蓄电池的正负极的极性将____________。
二甲醚(DME)一种清洁的替代燃料,不含硫,不会形成微粒,而且与汽油相比,排放的NO2更少,因此是优良的柴油机替代燃料。工业上利用一步法合成二甲醚的反应如下(复合催化剂为Cu0/Zn0/Al2 O2):2CO(g)+4H2(g) CH3OCH3(g)+H2O(g) △H=-204.7kJ/mol。
CH3OCH3(g)+H2O(g) △H=-204.7kJ/mol。
(1)若反应在恒温、恒压下进行,以下叙述能说明该反应达到平衡状态的是 。
| A.CO和H2的物质的量浓度比是1:2 |
| B.CO的消耗速率等于CH3OCH3的生成速率的2倍 |
| C.容器中混合气体的体积保持不变 |
| D.容器中混合气体的平均摩尔质量保持不变 |
E.容器中棍合气体的密度保持不变
(2)600℃时,一步法合成二甲醚过程如下:
CO(g)+2H2(g)=CH3OH(g) △H1=-100.46kJ/mol
2CH3OH(g)=CH3OCH3(g)+H2O(g) △H2
CO(g)+H2O(g)=CO2(g)+H2(g) △H3=-38.7kJ/mol
则△H2= 。
(3)复合催化剂的制备方法之一是Na2 C03共沉淀法:制备1 mol/L的硝酸铜,硝酸锌和硝酸铝的水溶液。然后向盛有去离子水的烧杯中同时滴加混合硝酸盐溶液和1 mol/L的Na2C03水溶液,70℃下搅拌混合。沉淀后过滤,洗涤沉淀物,80℃下干燥12小时,然后500℃下焙烧16小时。请写出上述过程中硝酸铝与Na2C03水溶液反应的离子方程式:
(4)以DME为燃料,氧气为氧化剂,在酸性电解质溶液中用惰性电极制成燃料电池,则通入氧气的电极是电源的 (填正、负)极,通DME的电极反应为 。
(1)今有2H2+O2  2H2O反应,构成燃料电池,则负极通入的应是 ,正极通的应是 。电极反应式为正极: ;负极: ;
2H2O反应,构成燃料电池,则负极通入的应是 ,正极通的应是 。电极反应式为正极: ;负极: ;
(2)若把KOH溶液改为稀H2SO4作电解质,则电极反应式为
正极: ;负极: ;
(1)和(2)的电解质不同,反应后,其溶液的pH各有什么变化? ;
(3)若把H2改为CH4,用KOH溶液作电解质溶液,则负极的电极反应式为 。
大功率镍氢动力电池及其管理模块,是国家“十五”863计划电动汽车专项中一项重要课题。我国镍氢电池居世界先进水平,解放军潜艇将装备国产大功率镍氢动力电池。常见镍氢电池的某极是储氢合金LaNi5H6(LaNi5H6中各元素化合价均为零),电池反应通常表示为:LaNi5H6+6NiO(OH) LaNi5+6Ni(OH)2,下列有关镍氢电池的说法,不正确的是
LaNi5+6Ni(OH)2,下列有关镍氢电池的说法,不正确的是
| A.电池工作时,储氢合金作负极 |
| B.电池充电时,阳极发生氧化反应 |
| C.电池工作时,负极反应式:LaNi5H6 + 6OH-−6e- ="=" LaNi5 + 6H2O |
| D.电池放电时,电子由正极通过外电路流向负极 |
有X、Y、Z、W四种短周期元素,原子序数依次增大。X的阳离子就是一个质子。Z、W在周期表中处于相邻位置,它们的单质在通常状况下均为无色气体。Y原子的最外层电子数是次外层电子数的2倍。请回答:
(1)Y的原子结构示意图为 ,YW2的结构式为 。
(2)将X2、W2按下图所示通人某燃料电池中,其中,b电极的电极反应式为 。

若有16gW2参加反应,转移的电子是 NA。
(3)由X、Y、Z、W四种元素组成的无机酸酸式盐,与足量的NaOH溶液在加热条件下反应的离子方程式为 。
直接甲醇燃料电池被认为是21世纪电动汽车最佳候选动力源.
(1)101KPa时,1mol气态CH3OH完全燃烧生成CO2气体和液态水时,放出726.51kJ的热量,则甲醇燃烧的热化学方程式是 .
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应原理是:
①CH3OH(g)+H2O (g)═CO2(g)+3H2(g);△H1═+49.0KJ•mol﹣1
②CH3OH(g)+ O2(g)═CO2(g)+2H2(g);△H2═?
O2(g)═CO2(g)+2H2(g);△H2═?
已知H2(g)+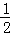 O2(g)═H2O (g)△H═﹣241.8KJ•mol﹣1,则反应②的△H2= .
O2(g)═H2O (g)△H═﹣241.8KJ•mol﹣1,则反应②的△H2= .
(3)一种甲醇燃料电池是采用铂或碳化钨作电极,稀硫酸作电解液,一极直接加入纯化后的甲醇,同时向另一个电极通人空气.则甲醇进入 极,正极发生的电极反应方程式为 .
酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是有碳粉,二氧化锰,氯化锌和氯化铵等组成的填充物,该电池在放电过程产生MnOOH,回收处理该废电池可以得到多种化工原料,有关数据下图所示:
溶解度/(g/100g水)

| 化合物 |
Zn(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
| Ksp近似值 |
10-17 |
10-17 |
10-39 |
回答下列问题:
(1)该电池的负极为 ,正极反应式为 ,
(2)维持电流强度为0.5A,电池工作5分钟,理论消耗Zn g(已知F=96500C/mol)。
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有氯化锌和氯化铵,两者可以通过 分离回收,滤渣的主要成分是二氧化锰、 和 ,欲从中得到较纯的二氧化锰,最简便的方法是 ,其原理是 。
(4)用废电池的锌皮制作七水合硫酸锌,需去除少量杂质铁,其方法是:加入稀硫酸和双氧水,溶解,铁变为 加碱调节PH为 ,铁刚好完全沉淀(离子浓度≤1×10-5mo1·L-1时即可认为离子沉淀完全)继续加碱调节PH为 锌开始沉淀(假定此时溶液中Zn2+的浓度为0.1 mo1·L-1)。若上述过程不加双氧水的后果 ,原因是 。
我国知名企业比亚迪公司开发了具有多项专利的锂钒氧化物二次电池,其成本较低,对环境无污染,能量密度远远高于其他电池,电池总反应为V2O5 + xLi 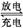 LixV2O5。下列说法合理的是
LixV2O5。下列说法合理的是
| A.电池在放电时,Li+向负极移动 |
| B.锂在放电时作正极,充电时作阳极 |
| C.该电池充电时阳极的反应为LixV2O5 _ xe-=V2O5 + xLi+ |
| D.V2O5只是锂发生反应的载体,不参与电池反应 |
能源问题是人类社会面临的重大课题。甲醇是未来重要的绿色能源之一。
(l)已知:在 25 ℃、101 kPa 下,1g 甲醇燃烧生成 CO2和液态水时放热 22.70kJ。
请写出甲醇燃烧的热化学方程式 。
(2)由CO2和H2合成甲醇的化学方程式为:
CO2(g)+ 3H2 (g)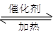 CH3OH(g)+H2O (g )
CH3OH(g)+H2O (g )
在其它条件不变的情况下,实验测得温度对反应的影响如下图所示(注:T1、T2均大于300 ℃)

①合成甲醇反应的△H 0。(填“>”、“<”或“="”" )。
②平衡常数的表达式为: .温度为T2时的平衡常数 温度为T1时的平衡常数(填“>”、“<”或“=”)
③在T1温度下,将1mol CO2和 1 molH2充入一密闭恒容容器中,充分反应达到平衡后,若CO2转化率为α,则容器内的压强与起始压强的比值为 。
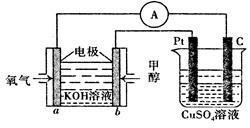
(3)利用甲醇燃料电池设计如下图所示的装置。该装置中 Pt 极为 极;写出 b极的电极反应式 .
镁及其化合物一般无毒(或低毒)、无污染,且镁电池放电时电压高而平稳,越来越成为人们研制绿色原电池的关注焦点。其中一种镁电池的反应为:xMg+Mo3S4 MgxMo3S4,下列说法正确的是
MgxMo3S4,下列说法正确的是
| A.电池放电时,Mg2+向负极迁移 |
| B.电池放电时,正极反应为Mo3S4+2xe-+xMg2+=MgxMo3S4 |
| C.电池充电时,阴极发生还原反应生成Mo3S4 |
| D.电池充电时,阳极反应为xMg﹣2xe-=xMg2+ |
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O Cd(OH)2 +2Ni(OH)2
Cd(OH)2 +2Ni(OH)2
有关该电池的说法正确的是
| A.充电时阳极反应:Ni(OH)2-e— + OH- ="=" NiOOH + H2O |
| B.充电过程是化学能转化为电能的过程 |
| C.放电时负极附近溶液的碱性不变 |
| D.放电时电解质溶液中的OH- 向正极移动 |
铅蓄电池是最常见的二次电池,其电池总反应可以表示为:
Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(l),下列说法不正确的是
2PbSO4(s)+2H2O(l),下列说法不正确的是
| A.电池的电解液为酸性溶液,正极为PbO2、负极为Pb |
| B.电池放电时,正极反应为PbO2+2 e-+SO42-+4H+=PbSO4+2H2O |
| C.电池充电过程中,阳极附近溶液的pH升高 |
| D.电池充电时,阴极反应为PbSO4+2e-=Pb+SO42- |
(1)今有2H2+O2 =2H2O反应,构成碱性KOH燃料电池,则负极电极反应式为 ,正极电极反应式是 。
(2)若把KOH改为稀H2SO4作电解质,则负极电极反应式为 ;正极电极反应式为 。(1)和(2)的电解质不同,反应进行后,其溶液的pH个有什么变化? 。
(3)若把H2改为CH4,用KOH作电解质,则负极电极反应式为 ;正极电极反应式为 。
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O Cd(OH)2 + 2Ni(OH)2 有关该电池说法正确是
Cd(OH)2 + 2Ni(OH)2 有关该电池说法正确是
| A.充电时阳极反应:Ni(OH)2-e- + OH- ="NiOOH" + H2O |
| B.充电过程是化学能转化为电能的过程 |
| C.放电时负极附近溶液的碱性不变 |
| D.放电时电解质溶液中的OH-向正极移动 |