某航空站安装了一台燃料电池,该电池可同时提供电和水蒸气。所用燃料为氢气,电解质为熔融的碳酸钾。已知该电池的总反应为2H2+O2===2H2O,正极反应为O2+2CO2+4e-===2CO32-,则下列推断正确的是
| A.负极反应为H2+2OH--2e-===2H2O |
| B.该电池可在常温或高温时进行工作,对环境具有较强的适应性 |
| C.该电池供应2 mol水蒸气,同时转移2 mol电子 |
| D.放电时负极有CO2生成 |
某充电宝锂离子电池的总反应为:xLi+Li1﹣xMn2O4 LiMn2O4,某手机镍氢电池总反应为:NiOOH+MH
LiMn2O4,某手机镍氢电池总反应为:NiOOH+MH M+Ni(OH)2(M为储氢金属或合金),有关上述两种电池的说法不正确的是
M+Ni(OH)2(M为储氢金属或合金),有关上述两种电池的说法不正确的是

| A.锂离子电池放电时Li+ 向正极迁移 |
| B.锂离子电池充电时,阴极的电极反应式:LiMn2O4﹣xe﹣═Li1﹣xMn2O4+xLi+ |
| C.如图九表示用锂离子电池给镍氢电池充电 |
| D.镍氢电池放电时,负极的电极反应式:MH+OH--e-═H2O+M |
用于电动汽车的铝-空气燃料电池通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。则下列说法正确的是
| A.以NaOH溶液为电解液时,负极反应为Al+3OH--3e-=Al(OH)3↓ |
| B.以NaCl溶液或NaOH溶液为电解液时,正极反应都为O2+2H2O+4e-=4OH- |
| C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变 |
| D.电池工作时,电子通过外电路从正极流向负极 |
银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为:Ag2O+Zn+H2O  2Ag+Zn(OH)2 在此电池放电时,负极上发生反应的物质是
2Ag+Zn(OH)2 在此电池放电时,负极上发生反应的物质是
| A.Zn | B.Ag | C.Ag2O | D.Zn(OH)2 |
碱性电池具有容量大、放电电流大的特点,得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+ MnO2(s)+H2O(l)="=ZnO" (s)+Mn(OH)2 (s) ,下列说法错误的是
| A.电池工作时,锌失去电子 |
| B.电池工作时,电子由正极通过外电路流向负极 |
| C.电池正极的电极反应式为:MnO2(s)+ 2H2O(1)+2e— = Mn(OH)2 (s) +2OH—(aq) |
| D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
一种碳纳米管能够吸附氢气,用这种材料吸氢后制备的二次电池(充放电电池)工作原理如下图所示,该电池的电解质为6 mol·L-1KOH溶液,下列说法中正确的是
| A.放电时K+移向碳电极 |
| B.放电时电池负极的电极反应为H2-2e-= 2H+ |
| C.充电时镍电极的电极反应为Ni(OH)2 + OH――e-= NiO(OH) + H2O |
| D.该电池充电时将碳电极与电源的正极相连,发生氧化反应 |
镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按右式进行:Cd+2NiOOH+2H2O Cd(OH)2+2Ni(OH)2由此可知,该电池充电时在阴极上发生反应的是
Cd(OH)2+2Ni(OH)2由此可知,该电池充电时在阴极上发生反应的是
| A.Ni(OH)2 | B.Cd(OH)2 | C.Cd | D.NiOOH |
下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述错误的是
| A.a电极是负极 |
| B.b电极上发生氧化反应 |
| C.氢氧燃料电池是一种具有应用前景的绿色电源 |
| D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置 |
氨气是一种重要工业原料,在工农业生产中具有重要的应用。
(1)已知:N2(g)+O2(g)=2NO(g) △ H=+180.5kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
则N2(g)+3H2(g)=2NH3(g)的△H=_________________________。
(2)工业合成氨气的反应为N2(g)+3H2(g) 2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的密闭容器中达到平衡后.改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是__________________。
①增大压强 ②增大反应物的浓度 ③使用催化剂 ④降低温度
(3)①实验室常用加热氯化铵固体和氢氧化钙固体的混合物来制取氨气,画出反应及收集的简易装置实验室还可在 (填一种试剂)中滴加浓氨水的方法快速制取少量氨气。
② 常温下氨气极易溶于水,溶液可以导电。氨水中水电离出的c(OH-) 10-7 mol·L-1(填写“>”、“<”或“=”);
③ 将相同体积、PH之和为14的氨水和盐酸混合后,溶液中离子浓度由大到小的顺序
为 。
(4)合成氨的原料氢气是一种新型的绿色能源,具有广阔的发展前景。现用氢氧燃料电池进行图所示实验:(其中a、b均为碳棒)。如图所示:

右边Cu电极反应式是
a电极的电极反应式
一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是
A.反应CH4+H2O 3H2+CO,每消耗1molCH4转移12mol电子 3H2+CO,每消耗1molCH4转移12mol电子 |
| B.电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O |
| C.电池工作时,CO32-向电极B移动 |
| D.电极B上发生的电极反应为:O2+2CO2+4e-=2CO32- |
铅蓄电池的充、放电反应方程式为:Pb+PbO2+2H2SO4 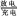 2PbSO4+2H2O。
2PbSO4+2H2O。
关于铅蓄电池的说法正确的是
| A.放电时,正极发生的反应是:Pb(s)+SO42--2e-===PbSO4(s) |
| B.充电时,每消耗1 mol PbSO4的同时转移2mol 电子 |
| C.放电时,该电池的负极材料是铅板 |
| D.充电时,电池中硫酸的浓度不断变小 |
镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金。该电池在充电过程中的总反应方程式是:Ni(OH)2 + M=NiOOH + MH,已知:6NiOOH + NH3 + H2O + OH-=6Ni(OH)2 + NO2-,下列说法正确的是
| A.NiMH电池放电过程中,正极的电极反应式为:NiOOH+H2O+e-=Ni(OH)2 +OH- |
| B.充电过程中OH-离子从阳极向阴极迁移 |
| C.充电过程中阴极的电极反应式:H2O+M+e-=MH+OH-,H2O中的H被M还原 |
| D.NiMH电池中可以用KOH溶液、氨水等作为电解质溶液 |
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:
Cd + 2NiOOH + 2H2O Cd(OH)2 + 2Ni(OH)2有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2有关该电池的说法正确的是
| A.充电时阳极反应:Ni(OH)2-e- + OH-=NiOOH + H2O |
| B.充电过程是化学能转化为电能的过程 |
| C.放电时负极附近溶液的碱性不变 |
| D.放电时电解质溶液中的OH-向正极移动 |
H2S废气资源化利用途径之一是回收能量并得到单质硫。反应原理为:2H2S(g) + O2(g) = S2(s) + 2H2O(l)  H=-632kJ·mol-1。右图为质子膜H2S燃料电池的示意图。下列说法正确的是
H=-632kJ·mol-1。右图为质子膜H2S燃料电池的示意图。下列说法正确的是
| A.电极a为电池的正极 |
B.电极b上发生的电极反应为:O2+2H2O+4e =" 4" OH =" 4" OH |
| C.电路中每流过4mol电子,电池内部释放632kJ热能 |
| D.每17gH2S参与反应,有1mol H+经质子膜进入正极区 |