由硫可制得多硫化钠Na2Sx,x的值一般为2~6。当x=2时,多硫化钠称为过硫化钠。
Ⅰ.过硫化钠加入盐酸中有硫沉淀析出,写出该反应的化学方程式 ,该反应的还原产物是 。
Ⅱ.某些多硫化钠可用于制作蓄电池。下图是一种正在投入生产的大型蓄电系统的原理图。
电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜只允许钠离子通过。电池充、放电的化学反应方程式为:

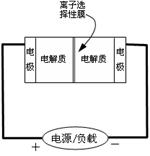
(1)电池中的左侧“电极”的电极名称是 (填“正极”或“负极”)。
(2)放电过程中钠离子从 (选“左到右”或“右到左”)通过离子交换膜。
(3)写出充电过程中阳极的电极反应式 。
(14分)
(1)最早使用的化学电池是锌锰电池,即大家熟悉的干电池。这种电池在使用过程中,锌外壳会逐渐变薄,最后内部糊状的电解质会泄漏出来,使电器腐蚀。后来人们采用了什么方法将其改造成了防漏电池。请列举一种方法即可_____________。
这种电池还有一个缺点:即使不用,放置过久,也会失效,请说明失效的原因_________。
(2)为提高电池寿命和提高其性能,人们将电池内的电解质NH4Cl换成湿的KOH,并在构造上做了改进,制成了碱性锌锰电池。其总反应为:
Zn + 2MnO2 + 2H2O ="===" 2MnOOH + Zn(OH)2
写出该电池正极反应式___________。电池工作时,电子流向 (填“正”或“负”)极。
(3)二氧化锰是制造锌锰干电池的基本材料。MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是 。若电解电路中通过2mol电子,MnO2的理论产量为 。
(4)生产MnO2另一种方法:以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰。流程如下:
某软锰矿的主要成分为MnO2,还含有Si(16.72%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Cu(OH)2 |
Zn(OH)2 |
CuS |
ZnS |
MnS |
FeS |
| pH |
5.2 |
3.2 |
9.7 |
10.4 |
6.7 |
8.0 |
≥–0.42 |
≥2.5 |
≥7 |
≥7 |
①硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式
为 。
②加入MnS的目的是除去 杂质。
肼(N2H4)又称联氨,是一种可燃性液体,用作火箭燃料。

(1)32.0g该液态化合物在氧气中完全燃烧生成氮气放出热量624kJ(25°C,101kPa),则肼完全燃烧的热化学方程式 。
(2)肼——空气燃料电池是一种无污染的清洁的碱性燃料电池,电解质溶液是20%—30%的KOH溶液。该电池放电时,作负极的燃料是 (填化学式);正极的电极反应式是 。
(3)右图是一个电化学过程示意图。
①锌片上发生的电极反应是________________________。
②假设使用肼一空气燃烧电池作为本过程中的电源,锌片的质量
变化是128g,则肼一空气燃料电池理论上消耗标准状况下的空气_____L
(假设空气中氧气体积含量为20%)
铅蓄电池是化学电源,其电极材料分别是Pb和PbO2,电解质溶液为稀硫酸。工作时,该电池的总反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O根据上述情况判断:
(1)蓄电池的负极是______,其电极反应式为______。
(2)蓄电池的正极是______,其电极反应式为______。
(3)蓄电池工作时,其中电解质溶液的pH______(增大、减小、不变)。
(4)实验室用铅蓄电池作电源电解饱和食盐水制取氯气,今若制得Cl2 0.050mol,这时电池内消耗的H2SO4的物质的量至少是 。
Li—SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2 ="4LiCl+S" +SO2。 请回答下列问题:
请回答下列问题:
 (1)电池的负极材料为 ,发生的电极反应为 ;
(1)电池的负极材料为 ,发生的电极反应为 ; (2)电池正极发生的电极反应为 ;
(2)电池正极发生的电极反应为 ; (3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。 如果把少量水滴到SOCl2中,实验现象是 ,反应的化学方程式为 ;
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。 如果把少量水滴到SOCl2中,实验现象是 ,反应的化学方程式为 ; (4)组装该电池必须在无水、无氧的条件下进行,原因是 。
(4)组装该电池必须在无水、无氧的条件下进行,原因是 。
(1)阿波罗宇宙飞船使用的是以KOH为介质的氢、氧燃料电池(如下图),按下列要求填空:
(1)①__________(填“负”或“阴”)极反应式:;②__________(填“正”或“阳”)极反应式:_________________;③电池反应式_________________________________。
(2)如图所示装置,A、B中的电极为多孔的惰性电极;C、D为夹在湿的Na2SO4滤纸条上的铂夹;电源有a、b两极。若A、B中充满KOH溶液后倒立于KOH溶液的水槽中,切断K1,闭合K2、K3通直流电,回答下列问题:
①判断电源的正、负极:a为___________极,b为极___________。
②在湿的Na2SO4溶液滤纸条中心的KMnO4液滴,有什么现象?______________________。
③写出电极反应式:A极______________________,C极______________________。
④若A极产生气体的体积在标准状况下为x L,则C极上产物的质量大约为___________g。
⑤若电解一段时间后,A、B中均有气体包围电极,此时切断K2、K3,闭合K1,则电流表的指针是否移动___________(填“是”或“否”)。若电流表指针不移动说明理由,若指针移动也说明理由。
把a、b、c、d4块金属片浸入稀H2SO4中,分别用导线两两相连可以组成原电池。a、b相连时,a为负极;c、d相连时,电流由d→c;a、c相连时c极上产生大量气泡;b、d相连时,d极发生氧化反应。这4种金属的活动性由强到弱的顺序是________。
请仔细观察两种电池的构造示意图,回答下列问题:
(1)碱性锌锰电池的总反应式:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,则负极的电极反应式:
(2)碱性锌锰电池比普通锌锰电池(干电池)性能好,放电电流大。试从影响反应速率的因素分析
其原因是
(3)某工厂回收废旧锌锰电池,其工艺流程如下:
已知:生成氢氧化物的pH如下表:
| 物质 |
Fe(OH)3 |
Fe(OH)2 |
Zn(OH)2 |
Mn(OH)2 |
| 开始沉淀pH |
2.7 |
7.6 |
5.7 |
8.3 |
| 完全沉淀pH |
3.7 |
9.6 |
8.0 |
9.8 |
①经测定,“锰粉”中除含少量铁盐和亚铁盐外,主要成分应是MnO2、Zn(OH)2 。
②第一次加入H2O2后,调节pH=8.0。目的
是 。
③试列举滤液4的应用实
例 。
.⑴今有2H2+O2 2H2O反应,设计成燃料电池,则负极通的应是 ,正极通的应是 ,电极反应式为: 、 。
2H2O反应,设计成燃料电池,则负极通的应是 ,正极通的应是 ,电极反应式为: 、 。
⑵如把KOH改为稀H2SO4作电解质,则电极反应式为: 、
。⑴和⑵的电解液不同,反应进行后,其溶液的PH值变化为 、 。
⑶如把H2改为甲烷,KOH作电解质,则负极反应式为: 。
美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的电池,其构造如图所示:两个电极均由多孔碳制成,通入的气体由孔隙中流出,并从电极表面放出。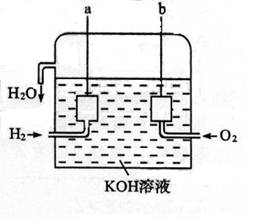
⑴a极是 ,电极反应式是 。
⑵b极是 ,电极反应式是 。
⑶氢气是燃料电池最简单的燃料,虽然使用方便,却受到价格和来源的限制。常用的燃料往往是某些碳氢化合物,如甲烷(天然气)、汽油等。请写出甲烷燃料电池中a极的电极反应式为 。此时电池内的总反应方程式为 。
常见铅蓄电池是二次电池,其电极材料分别为Pb和PbO2,电解液为稀H2SO4溶液,工作时的总反应式为Pb +PbO2+ 2H2SO4 2PbSO4 +2H2O。请依据上述情况判断:⑴铅蓄电池的负极材料是 。
2PbSO4 +2H2O。请依据上述情况判断:⑴铅蓄电池的负极材料是 。
⑵请依据两极材料和总反应,写出放电时正极反应是 。
⑶请依据总反应式和正极反应式,写出放电时负极反应是 。
⑷放电时,电解质溶液中阴离子移向 极;电流方向从 极流向 极。
⑸放电时,电解质溶液的酸性 (填“增强”、“减弱”或“不变”)。
⑹充电时PbO2极发生 反应,电极反应式 ;Pb极发生 反应,电极反应式 。
在下图所示装置中,试管A、B中的电极为多孔的惰性电极;C、D为两个铂夹夹在被Na2SO4溶液浸湿的滤纸条上,滤纸条的中部滴有KMnO4液滴;电源有a、b两极。若在A、B中充满KOH溶液后倒立于盛KOH溶液的水槽中,断开K1,闭合K2、K3,通直流电,实验现象如图所示,请回答下列问题: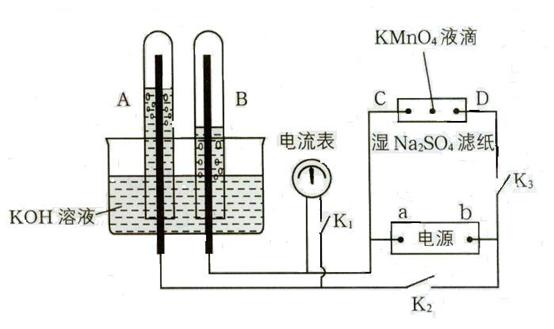
⑴标出电源的正、负极:a为 极,b为 极。
⑵在湿的Na2SO4滤纸条的中部KMnO4液滴处发生的现象为 。
⑶若电解一段时间后,A、B中均有气体包围电极。此时切断K2、K3,闭合K1,则电流表的指针 (填是或否)偏转,其理由是
。
⑷若电流表的指针发生偏转,请写出有关的电极反应式:A中 ;
B中 (若指针不发生偏转,则此题不需要回答)。若指针不发生偏转,请说明理由 (若指针发生偏转,则此题不需要回答)。
英国国家海洋学中心于2009年8月14日发布新闻公报说,中心的研究人员及其同行利用声呐等手段探测到北极海洋中存在大量甲烷气泡,证实了全球变暖会使海底释放大量甲烷的说法。研究人员认为,这些甲烷可能会反过来加剧全球变暖。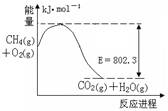
(1)右图是1molCH4和O2完全反应生成CO2气体与水蒸气过程中能量变化示意图,又已知 H2O(l)=H2O(g) △H=44.0kJ·mol-1,请写出1molCH4和O2完全反应生成CO2气体与液态水的热化学方程式 。
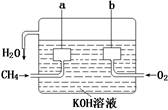
(2)美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的电池,氢气虽然使用方便,却受到价格和来源的限制。常用的燃料往往是某些碳氢化合物,如甲烷(天然气)、汽油等。电池的构造如图所示:两个电极均由多孔碳制成,通入的气体由孔隙中流出,并从电极表面放出。
①请写出甲烷燃料电池中a极的电极反应式为 。
②此时电池内的总反应方程式为 。
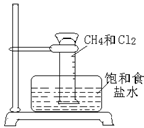
(3)某课外活动小组利用右图所示装置探究甲烷于氯气的反应。根据题意,回答下列问题:
①CH4与Cl2发生反应的条件是 ;若用日光直射,可能会引起 。
②实验中可观察的实验现象有:量筒内壁出现油状液滴,饱和食盐水中有少量固体析出, , 等。
③用饱和食盐水而不用谁的原因是 。
④实验中生成的油状液滴中的氯仿可作局部麻醉剂,常因保存不慎而被空气氧化,产生剧毒气体——光气,反应化学方程式为2CHCl3+O2→2COCl2+2HCl,上述反应 (填选项符号,下同)
A.属于取代反应 B.不属于取代反应
为防止事故发生,在使用前检验氯仿是否变质可选用的试剂是
A.氢氧化钠溶液 B.硝酸银溶液 C.稀盐酸
D.水 E.湿润的蓝色石蕊试纸 F.湿润的无色酚酞试纸