燃料电池是利用燃料(如H2、CO、CH4等)跟氧气反应从而将化学能转化成电能的装置。下列关于甲烷燃料电池(NaOH溶液作电解质)的说法中正确的是
| A.负极反应为:O2+2H2O+ 4e-= 4OH- |
| B.负极反应为:CH4+ 10OH-- 8e-= CO32- + 7H2O |
| C.放电时正极发生氧化反应,外电路中电子从正极流向负极 |
| D.随着放电的进行,溶液的pH保持不变 |
一种新型酸性乙醇电池用磺酸类质子作溶剂,比甲醇电池效率高出32倍,电池反应式为C2H5OH + 3O2 =" 2" CO2 + 3H2O,电池构造如下图。下列关于该电池的说法不正确的是
| A.放电过程中,电源内部的H+从正极区向负极区迁移 |
| B.通入乙醇的电极是负极 |
| C.该电池的正极反应为:4H+ + O2 + 4e-= 2H2O |
| D.用该电池做为电源,用惰性电极电解饱和NaCl的水溶液时,每消耗0.2 mol C2H5OH,阳极产生标准状况下气体的体积为26.88 L |
Al-AgO 电池性能优越,可用作水下动力电源,其原理如图所示。该电池反应的化学方程式为:2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O,则下列说法正确的是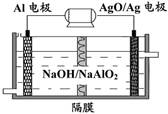
| A.AgO/Ag电极是负极 |
| B.当电极上析出1.08 g Ag时,电路中转移的电子为0.02mol |
| C.Al电极的反应式为:Al—3e-+4OH-= AlO2-+2H2O |
| D.在电解质溶液中OH-由Al电极移向AgO/Ag电极 |
下图是生活中常用的锌锰干电池的示意图,下列有关说法中不正确的是( ) 
| A.电池内部含有电解质 | B.锌是负极,碳棒是正极 |
| C.电池用完后可埋入土壤 | D.锌锰干电池属一次电池 |
已知铅蓄电池放电过程可以表示为PbO2 + 2 H2SO4 + Pb="2" PbSO4 + 2H2O下列关于铅蓄电池的说法正确的是
| A.Pb为正极,PbO2为负极 |
| B.正极电极反应式为PbO2 + SO4 2- + 2H+ =PbSO4 + H2O |
| C.硫酸溶液中,H+移向负极 |
| D.放电一段时间后,SO4 2-浓度减小 |
蓄电池放电时是起原电池的作用,在充电时起电解池的作用。下式是爱迪生蓄电池分别在充电、放电时的反应: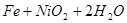
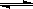
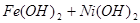 ,下列有关爱迪生电池的各种推断中错误的是( )。
,下列有关爱迪生电池的各种推断中错误的是( )。
A.放电时铁做负极,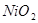 做正极 做正极 |
B.充电时阴极上的电极反应为: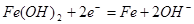 |
| C.放电时,电解质溶液中的阴离子是向正极方向移动 |
| D.蓄电池的两个电极必须浸入在碱性溶液中 |
“天宫一号”的供电系统(RFC)是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池。下图为RFC工作原理示意图,有关说法正确的是( )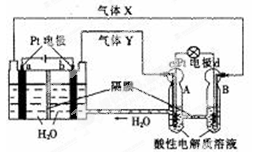
A.当有0.1 mol电子转移时,a极产生1. 12 LH2
B.b极上发生的电极反应是:4H2O +4e-=2H2↑+4OH-
C.d极上发生的电极反应是:O2 +4H+ +4e-=2H2O
D.c极上发生还原反应,B中的H+通过隔膜进入A
电池是人类生产和生活中的重要能量来源,各式各样电池的发明是化学对人类的一项重大贡献。下列有关电池的叙述正确的是( )
| A.锌锰干电池工作一段时间后碳棒变细 |
| B.氢氧燃料电池可将热能直接转变为电能 |
| C.氢氧燃料电池工作时氢气在负极被氧化 |
| D.太阳能电池的主要材料是高纯度的二氧化硅 |
下列有关电池叙述不正确的是( )
| A.锌锰干电池是一种常用的二次电池 |
| B.氢氧燃料电池比火力发电的能量转变率要高 |
| C.锌锰干电池工作一段时间后锌外壳逐渐变薄 |
| D.碱性燃料电池正极反应是O2 + 2H2O + 4e- =4OH- |
下列有关电池的说法错误的是
| A.手机上用的锂离子电池属于二次电池 |
| B.铅蓄电池中负极为铅,电解质是硫酸 |
| C.氢氧燃料电池正极输入氢气,负极输入空气 |
| D.锌锰干电池即使不用,长久放置也会失效 |
某CH4燃料电池,工作环境是熔融的金属氧化物(MO),它能传导O2-,有关CH4燃料电池的说法中正确的是
| A.电池内部电子从正极流向负极 |
| B.负极电极反应式为:CH4-8e- + 10OH-=CO32-+ 7H2O |
| C.正极电极反应式为:O2 + 4e-=2O2- |
| D.每消耗22.4 L CH4,外线路中将通过8 mol电子 |
氢氧燃料电池已用于航天飞机。以稀硫酸溶液为电解质溶液的这种电池在使用时的电极反应如下:
负极:2H2—4e—= 4H+; 正极: O2+4e—+4H+ =2H2O
据此作出判断,下列说法中正确的是
| A.O2在正极发生氧化反应 | B.供电时的总反应为:2H2+O2=2H2O |
| C.氢氧燃料电池是把电能转化为化学能 | D.燃料电池的能量转化率可达100% |
微型钮扣电池在现代生活中有广泛应用。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:Zn+2OH--2e-===ZnO+H2O;Ag2O+H2O+2e-===2Ag+2OH-根据上述反应式,判断下列叙述中正确的是
| A.在使用过程中,电池负极区溶液的pH减小 |
| B.使用过程中,电子由Ag2O极经外电路流向Zn极 |
| C.Ag2O是负极,Zn是正极 |
| D.Zn电极发生还原反应,Ag2O电极发生氧化反应 |
下列说法不正确的是
| A. | 多孔碳可用作氢氧燃料电池的电极材料 |
| B. |
|
| C. |
科学家发现一种新细菌的
|
| D. |
 和 和
 ,反应符合绿色化学的原则 ,反应符合绿色化学的原则
|
热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:
。下列有关说法正确的

| A. |
正极反应式:
|
| B. |
放电过程中,
|
| C. |
没转移0.1
|
| D. | 常温时,在正负极间接上电流表或检流计,指针不偏转 |