镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金。该电池在充电过程中的总反应方程式是:Ni(OH)2 + M=NiOOH + MH,已知:6NiOOH + NH3 + H2O + OH-=6Ni(OH)2 + NO2-,下列说法正确的是
| A.NiMH电池放电过程中,正极的电极反应式为:NiOOH+H2O+e-=Ni(OH)2 +OH- |
| B.充电过程中OH-离子从阳极向阴极迁移 |
| C.充电过程中阴极的电极反应式:H2O+M+e-=MH+OH-,H2O中的H被M还原 |
| D.NiMH电池中可以用KOH溶液、氨水等作为电解质溶液 |
H2S废气资源化利用途径之一是回收能量并得到单质硫。反应原理为:2H2S(g) + O2(g) = S2(s) + 2H2O(l)  H=-632kJ·mol-1。右图为质子膜H2S燃料电池的示意图。下列说法正确的是
H=-632kJ·mol-1。右图为质子膜H2S燃料电池的示意图。下列说法正确的是
| A.电极a为电池的正极 |
B.电极b上发生的电极反应为:O2+2H2O+4e =" 4" OH =" 4" OH |
| C.电路中每流过4mol电子,电池内部释放632kJ热能 |
| D.每17gH2S参与反应,有1mol H+经质子膜进入正极区 |
用铅蓄电池电解甲、乙电解池中的溶液。已知铅蓄电池的总反应为:
Pb (s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O (l),电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是
| A.d极为阴极 |
| B.放电时铅蓄电池负极的电极反应式为:PbO2(s)+4H+(aq)+SO42-(aq)+4e-=PbSO4 (s)+2H2O (l) |
| C.若利用甲池精炼铜,b极应为粗铜 |
| D.若四个电极材料均为石墨,当析出6.4 g Cu时,两池中共产生气体3.36 L(标准状况下) |
液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。一种以肼(N2H4)为燃料的电池装置如图所示。该电池用空气中的氧气作为氧化剂,KOH作为电解质。下列关于该燃料电池的叙述不正确的是
| A.电流从右侧电极经过负载后流向左侧电极 |
| B.负极发生的电极反应式为:N2H4+4OH--4e-=N2+4H2O |
| C.该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触 |
| D.该燃料电池持续放电时,K+从负极向正极迁移,因而离子交换膜需选用阳离子交换膜 |
某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是
| A.电子通过外电路从b极流向a极 |
| B.b极上的电极反应式为:O2+2H2O+4e-=4OH-- |
| C.每转移0.1mol电子,消耗1.12L的H2 |
| D.H+由a极通过固体酸电解质传递到b极 |
(1)0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,其热化学反应方程式为 ;
又知H2O(l)=H2O(g);△H=+44kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时,放出的热量是 kJ
(2)发射卫星时可用肼(N2H4)为燃料和NO2作氧化剂,这两者反应生成N2和水蒸气.又已知: ①N2(气)+2O2(气)=2NO2(气) △H=+67.7kJ/mol ②N2H4(气)+O2(气)=N2(气)+2H2O(气) △H=-534kJ/mol 试写出肼与NO2反应的热化学方程式:
(3)甲烷燃料电池:碱性电解质(铂为两极、电解液KOH溶液)
正极:___________ _____
负极:__________
总反应方程式: CH4+ 2O2 + 2OH- = CO32- + 3H2O
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:2CH3OH+3O2 + 4OH-  2CO32-+6H2O,则下列说法错误的是
2CO32-+6H2O,则下列说法错误的是
| A.放电时CH3OH参与反应的电极为正极 |
| B.充电时电解质溶液的pH逐渐增大 |
| C.放电时负极的电极反应为:CH3OH - 6e- + 8OH-=CO32-+6H2O |
| D.充电时每生成1molCH3OH转移6mol电子 |
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:2CH3OH + 3O2 + 4OH— =2CO32— + 6H2O,则下列说法错误的是
| A.放电时CH3OH参与反应的电极为正极 |
| B.充电时电解质溶液的pH逐渐增大 |
| C.放电时负极的电极反应为:CH3OH-6e-+8OH- = CO32— + 6H2O |
| D.充电时每生成1 mol CH3OH转移6 mol电子 |
分Ⅰ.甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景。
(1)工业生产甲醇的常用方法是CO(g)+2H2(g)===CH3OH(g) ΔH=-90.8 kJ·mol-1。
已知:2H2(g)+O2(g)===2H2O(l)ΔH=-571.6 kJ·mol-1
H2(g)+1/2O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
①H2的燃烧热ΔH=___________kJ·mol-1。
②CH3OH(g)+O2(g)===CO(g)+2H2O(g)的反应热ΔH=________________。
(2)工业上利用甲醇制备氢气常用方法之一是甲醇蒸气重整法。该法中的一个主要反应为CH3OH(g)===CO(g)+2H2(g),此反应能自发进行的原因是____________________________。
Ⅱ.铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:
Pb+PbO2+4H++2SO42-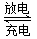 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题(不考虑氢、氧的氧化还原):
(1)放电时:正极的电极反应式是________________;当外电路通过1 mol电子时,理论上负极板的质量增加________g。
(2)在完全放电耗尽PbO2和Pb时,若按图连接,电解一段时间后,则在A电极上生成________、B电极上生成________。
开发新能源,使用清洁燃料,可以达到减少污染的目的。
(1)由C、H、O三种元素中的两种和三种分别组成的燃料物质甲和乙,其分子中均有氧,且1个乙分子中含有18个电子,则甲和乙分别是 。乙是一种清洁燃料,工业上可用甲和氢气反应制得。
① T1温度时,在体积为2 L的密闭容器中充入2 mol甲和6 mol H2,反应达到平衡后,测得c(甲)=0.2 mol/L,则乙在平衡混合物中的物质的量分数是 。(保留两位有效数字)
② 升高温度到T2时,反应的平衡常数为1,下列措施可以提高甲的转化率的是________(填字母)。
A.加入2 mol甲 B.充入氮气 C.分离出乙 D.升高温度
(2)甲烷也是一种清洁燃料,但不完全燃烧时热效率降低并会产生有毒气体造成污染。已知:
CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) ΔH1=―890.3 kJ/mol
2CO (g) + O2(g) = 2CO2(g) ΔH2=―566.0 kJ/mol
则甲烷不完全燃烧生成一氧化碳和液态水时的热效率是完全燃烧时的________倍(计算结果保留1位小数)。
(3)甲烷燃料电池可以提升能量利用率。右图是利用甲烷燃料电池电解50 mL 2 mol/L的氯化铜溶液的装置示意图(O2-可以在固态电解质中自由移动)。请回答:

① 甲烷燃料电池的负极反应式是 。
② 当线路中有0.1 mol电子通过时,______________(填“a”或“b”)极增重____________g。
如图所示,装置(Ⅰ)是一种可充电电池的示意图,装置(Ⅱ)为电解池的示意图;装置(Ⅰ)的离子交换膜只允许Na+通过。已知电池充、放电的化学方程式为2Na2S2+NaBr3 Na2S4+3NaBr。当闭合开关K时,X极附近溶液先变红色。下列说法中正确的是
Na2S4+3NaBr。当闭合开关K时,X极附近溶液先变红色。下列说法中正确的是

| A.闭合K时,装置(Ⅰ)中Na+从右到左通过离子交换膜 |
| B.闭合K时,A电极的电极反应式为NaBr3+2Na++2e-===3NaBr |
| C.闭合K时,X电极的电极反应式为2Cl--2e-===Cl2↑ |
| D.闭合K时,当有0.1 mol Na+通过离子交换膜,则X电极上析出气体在标准状况下的体积为1.12 L |
氨气是一种重要工业原料,在工农业生产中具有重要的应用。
(1)已知:N2(g)+O2(g)=2NO(g) △ H=+180.5kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
则N2(g)+3H2(g)=2NH3(g)的△H=________________。
(2)工业合成氨气的反应为N2(g)+3H2(g) 2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的密闭容器中达到平衡后.改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是____________。
①增大压强 ②增大反应物的浓度 ③使用催化剂 ④降低温度
( 3 )①实验室常用加热氯化铵固体和氢氧化钙固体的混合物来制取氨气,画出反应及收集的简易装置;
实验室还可在 (填一种试剂)中滴加浓氨水的方法快速制取少量氨气。
② 常温下氨气极易溶于水,溶液可以导电。氨水中水电离出的c(OH-) 10-7 mol·L-1(填写“>”、“<”或“=”);
③ 将相同体积、PH之和为14的氨水和盐酸混合后,溶液中离子浓度由大到小的顺序为 。
(4)合成氨的原料氢气是一种新型的绿色能源,具有广阔的发展前景。现用氢氧燃料电池进行图所示实验:(其中a、b均为碳棒)。如右图所示:

右边Cu电极反应式是 ,a电极的电极反应式
(10分)化学在能源开发与利用中起着十分关键的作用。氢气是一种新型的绿色能源,又是一种重要的化工原料。
氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行如图所示的实验(图中所用电极均为惰性电极):
(1)对于氢氧燃料电池,下列叙述不正确的是________。
| A.a电极是负极,OH-移向负极 |
| B.b电极的电极反应为:O2+2H2O+4e-===4OH- |
C.电池总反应式为:2H2+O2 2H2O 2H2O |
| D.电解质溶液的pH保持不变 |
E.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
(2)上图右边装置中盛有AgNO3溶液,当氢氧燃料电池工作一段时间后,AgNO3溶液的pH_____________(填“增大”、“减小”或“不变”)。
(3)已知甲醇的燃烧热ΔH=-726.5 kJ/mol,在直接以甲醇为燃料的电池中,电解质溶液为酸性,负极的反应式为_______________,正极的反应式为______________。
理想状态下,该燃料电池消耗1 mol甲醇所能产生的最大电能为702.1 kJ,则该燃料电池的理论效率为__________(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)。
(本小题满分15分)
参考下列图表和有关要求回答问题:

(1)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的一种原理是CH3OH(g)和H2O(g)反应生成CO2和H2。右图是该过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,正反应活化能 a的变化是_____________(填“增大”、“减小”、“不变”),反应热△H的变化是_____________(填“增大”、“减小”、“不变”)。请写反应进程出CH3OH(g)和H2O(g)反应的热化学方程式_____________。

(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的另一种反应原理是:CH3OH(g)+1/2O2(g)  CO2(g)+2H2(g) △H="c" kJ/mol又知H2O(g)
CO2(g)+2H2(g) △H="c" kJ/mol又知H2O(g)  H2O(l) △H="d" kJ/mol。则甲醇燃烧生成液态水的热化学方程式为_____________。
H2O(l) △H="d" kJ/mol。则甲醇燃烧生成液态水的热化学方程式为_____________。
(3)以CH3OH燃料电池为电源电解法制取ClO2。二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
①CH3OH燃料电池放电过程中,通入 O2的电极附近溶液的pH_____________,负极反应式为_____________。
②图中电解池用石墨作电极,在一定条件下电解饱和食盐水制取 ClO2。阳极产生 ClO2的反应式为_____________。
③电解一段时间,从阴极处收集到的气体比阳极处收集到气体多 6.72L时(标准状况,忽略生成的气体溶解),停止电解,通过阳离子交换膜的阳离子为_____________mol。