某原电池装置如下图所示,电池总反应为2Ag+Cl2===2AgCl。下列说法正确的是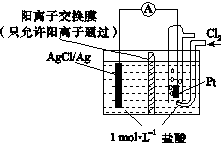
| A.正极反应为AgCl+e-===Ag+Cl- |
| B.放电时,交换膜右侧溶液中有大量白色沉淀生成 |
| C.若用NaCl溶液代替盐酸,则电池总反应随之改变 |
| D.当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子 |
工业上常用Fe作电极电解处理含Cr2O72-的酸性废水,最终使铬元素以Cr(OH)3沉淀的形式除去。某科研小组用该原理处理污水,设计装置如图所示。下列说法一定不正确的是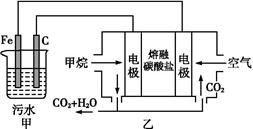
| A.燃料电池中若有1.6 g CH4参加反应,则甲中C电极理论上生成气体体积为8.96 L |
| B.实验时若污水中离子浓度较小,导电能力较差,可加入适量的Na2SO4 |
C.该燃料电池正极的电极反应式为:O2+4e-+2CO2 2 2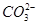 |
D.甲中阳极附近溶液中的离子反应方程式是: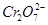 +6Fe2++14H+ +6Fe2++14H+ 2Cr3++6Fe3++7H2O 2Cr3++6Fe3++7H2O |
下图为某种甲醇燃料电池示意图,工作时电子流方向如图所示。下列判断正确的是
| A.X为氧气 |
| B.电极A反应式:CH3OH-6e-+H2O = CO2+6H+ |
| C.B电极附近溶液pH增大 |
| D.电极材料活泼性:A>B |
微型钮扣电池在现代生活中有广泛应用。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:Zn+2OH——2e=ZnO+H2O,Ag2O+H2O+2e=2Ag+2OH—,总反应为:Ag2O+Zn="2Ag+ZnO" 根据上述反应式,判断下列叙述中,正确的是:
| A.在使用过程中,电池负极区溶液pH值增大 |
| B.在使用过程中,电子由Ag2O极经外电路流向Zn极 |
| C. Zn是负极,Ag2O是正极 |
| D.Zn电极发生还原反应,Ag2O电极发生氧化反应 |
化学家正在研究尿素动力燃料电池,尿液也能发电。用这种电池直接去除城市废水中的尿素,既能产生净化的水,又能发电.尿素燃料电池结构如图所示,下列关于描述正确的是
| A.电池工作时H+移向负极 |
| B.该电池用的电解质溶液是KOH溶液 |
| C.甲电极反应式为:CO(NH2)2 + H2O-6e- ═ CO2 + N2 + 6 H+ |
| D.电池工作时,理论每净化1mol CO(NH2)2,消耗33.6 L O2 |
美国IBM公司设计出了一款新型锂空气电池,其原理就是通过吸入空气与设备内的锂离子发生反应,进行能量的提供。因其独特的放电方式,也称呼吸式电池。负极采用金属锂条,负极的电解液采用含有锂盐的有机电解液。中间设有用于隔开正极和负极的锂离子固体电解质。正极的水性电解液使用碱性水溶性凝胶,与由微细化碳和廉价氧化物催化剂形成的正极组合。如图所示。下列说法不正确的是 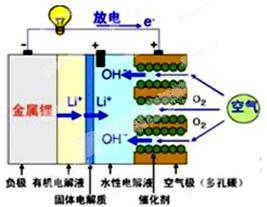
| A.负极反应:Li-e-=Li+,金属锂以锂离子(Li+)的形式溶于有机电解液,电子供应给导线。溶解的锂离子(Li+)穿过固体电解质移到正极的水性电解液中。 |
| B.正极反应:O2+2H2O+4e- =4OH-,在正极的水性电解液中与锂离子(Li+)结合生成水溶性氢氧化锂(LiOH),并能实现锂元素的循环。 |
| C.在负极的有机电解液和空气极的水性电解液之间,用只能通过锂离子的固体电解质隔开,以防止两电解液发生混合,而且能促进电池发生反应。 |
| D.锂-空气电池至今都未普及,原因是它存在致命缺陷,即固体反应生成物氧化锂(Li2O)在正极堆积,使电解液与空气的接触被阻断,从而导致放电停止。 |
研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl = Na2Mn5O10+2AgCl 下列“水” 电池在海水中放电时的有关说法正确的是( )
| A.正极反应式:Ag+Cl--e-="=" AgCl |
| B.每生成1 mol Na2Mn5O10转移2 mol电子 |
| C.Na+不断向“水”电池的负极移动 |
| D.AgCl是还原产物 |
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiO(OH) + 2H2O Cd(OH)2 + 2Ni(OH)2
Cd(OH)2 + 2Ni(OH)2
有关该电池的说法正确的是( )
A.充电时阳极反应:Ni(OH)2 + OH- -e- NiO(OH )+ H2O NiO(OH )+ H2O |
| B.充电过程是化学能转化为电能的过程 |
| C.放电时负极附近溶液的碱性不变 |
| D.放电时电解质溶液中的OH-向正极移动 |
肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂。试回答下列问题
(1)肼的结构式为 。
(2)肼燃料电池原理如图所示,左边电极上发生的电极反应式为_________________。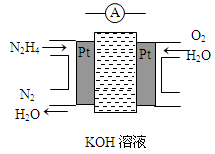
(3)火箭常用N2O4作氧化剂,肼作燃料,已知:
N2(g)+2O2(g)=2NO2(g) △H=-67.7kJ·mol-1 ①
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534.0kJ·mol-1 ②
2NO2(g)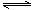 N2O4(g) △H=-52.7kJ·mol-1 ③
N2O4(g) △H=-52.7kJ·mol-1 ③
写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:___ _
(4)联氨的工业生产常用氨和次氯酸钠为原料获得,也可在催化剂作用下,用尿素
[CO(NH2)2]和次氯酸钠与氢氧化钠的混合溶液反应获得,尿素法反应的离子方程式为
____________________________________________________ 。
(5)如图所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊。关闭K2,将各1 mol NO2通过K1、K3分别充入A、B中,反应起始时A、B的体积相同且均为a L。
①B中可通过观察________________判断可逆反应2NO2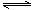 N2O4已经达到平衡。
N2O4已经达到平衡。
②若平衡后在A容器中再充入0.5mol N2O4,则重新到达平衡后,平衡混合气中NO2的体积分数_______________(填 “变大”“变小”或“不变”)。
③若容器A中到达平衡所需时间为t s,达到平衡后容器内压强为起始压强的0.8倍,则平均化学反应速率v(NO2)等于____________________。
④若打开K2,平衡后B容器的体积缩至0.4a L,则打开K2之前,气球B体积为_____L。
铁镍蓄电池又称爱迪生电池,放电时的总反应为Fe+Ni2O3+3H2O===Fe(OH)2+2Ni(OH)2下列有关该电池的说法不正确的是 ( )
| A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe |
| B.电池放电时,负极反应为Fe+2OH--2e-===Fe(OH)2 |
| C.电池充电过程中,阴极附近溶液的pH降低 |
| D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-===Ni2O3+3H2O |
LiFePO4新型锂离子电池因其原材料丰富、对环境友好、循环性能和安全性能好的特点,具有广阔的应用前景。已知该电池放电时的电极反应式为:
正极:FePO4+Li++e-=LiFePO4,负极:Li-e-=Li+,下列说法中正确的是
| A.充电时阳极反应为Li++e-=Li |
| B.充电时动力电池上标注“-”的电极应与外接电源的负极相连 |
| C.放电时电池内部Li+向负极移动 |
| D.放电时,在正极上是Li+得电子被还原 |
(9分)(1)一种新型锂电池是将化学式为Li4Ti5O12的物质作为电池的正极材料,在放电的过程中变为化学式为Li7Ti5O12的物质。
①Li4Ti5O12中Ti元素的化合价为 ,锂电池的突出优点是 。
②该锂电池是一种二次电池,放电时的负极反应式为 ,充电时的阳极反应式为 。
(2)用氧化还原滴定法测定制备得到的TiO2试样中的TiO2的质量分数:在一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作为指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
①TiCl4水解生成TiO2·xH2O的化学方程式为 。
②滴定终点的现象是 。
③滴定分析时,称取TiO2试样0.2g,消耗0.1mol·L-1 NH4Fe(SO4)2栎准溶液20ml.则TiO2的质量分数为____ 。
④若在滴定终点,读取滴定管刻度时,俯视标准溶液的液面,使其测定结果 (填“偏大”、“偏小”或“无影响”)。
(3)已知:
则TiCl4(l)+4Na(l)=Ti(s)+4NaCl(s)的△H= KJ·mol-1。
Ⅰ.重铬酸钾是工业生产和实验室的重要氧化剂,重铬酸钾的溶解度随温度影响较大。工业上常用铬铁矿(主要成分为FeO·Cr2O3,杂质为SiO2、Al2O3)为原料生产它,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下图。涉及的主要反应是:
6FeO·Cr2O3+24NaOH+7KClO3=12Na2CrO4+3Fe2O3+7KCl+12H2O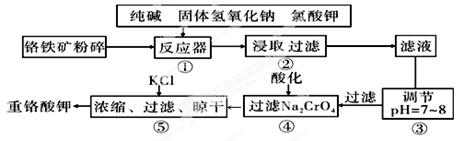
(1)碱浸前将铬铁矿粉碎的作用是 。
(2)步骤③调节pH后过滤得到的滤渣是 。
(3)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式 。
(4)用简要的文字说明操作⑤加入KC1的原因 。
(5)称取重铬酸钾试样2.500g配成250mL溶液,取出25mL于锥形瓶中,加入10mL 2mol/ LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min。然后加入100mL水,加入3mL淀粉指示剂,用0.1200 mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I一十S4O52-)
判断达到滴定终点的依据是 。
Ⅱ.氨作为一种富氢化合物,具有各种优点,特别是氨有着良好的产业基础,价格低廉,氨作为燃料电池燃料具有很大的发展潜力。氨氧燃料电池示意图,回答下列问题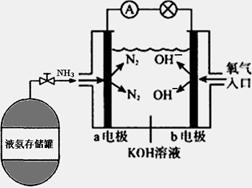
(1) a电极的电极反应式为_________________________;
(2)反应一段时间后,电解质溶液的pH将_________
(填“增大”“减小”或“不变”);
(3)已知:①N2(g)+3H2(g)=2NH3(g) △H="-92.4" kJ/mol,
②2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol,
试写出氨气完全燃烧生成气态水的热化学方程式:________________________;
(14分)工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图装置。实验时按如下步骤操作:
| A.连接全部仪器,使其成为如图装置,并检查装置的气密性。 |
| B.称取研细的辉铜矿样品1.000g。 |
| C.将称量好的样品小心地放入硬质玻璃管中。 |
| D.以每分钟1L的速率鼓入空气。 |
E.将硬质玻璃管中的辉铜矿样品加热到一定温度,发生反应为:Cu2S+O2=SO2 +2Cu。
F.移取25.00ml含SO2的水溶液于250ml锥形瓶中,用0.0100mol/L KMnO4标准溶液滴定至终点。按上述操作方法重复滴定2—3次。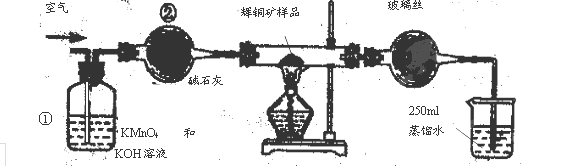
试回答下列问题:
(1)装置①的作用是_________________;装置②的作用是____________________。
(2)假定辉铜矿中的硫全部转化为SO2,并且全部被水吸收,则操作F中所发生反应的化学方程式为
(3)若操作F的滴定结果如下表所示,则辉铜矿样品中Cu2S的质量分数是_________。
| 滴定次数 |
待测溶液的体积/mL |
标准溶液的体积 |
|
| 滴定前刻度/mL |
滴定后刻度/mL |
||
| 1 |
25.00 |
1.04 |
21.03 |
| 2 |
25.00 |
1.98 |
21.99 |
| 3 |
25.00 |
3.20 |
21.24 |
(4)本方案设计中有一个明显的缺陷影响了测定结果(不属于操作失误),你认为是 (写一种即可)。
(5)已知在常温下FeS 的 Ksp= 6.25 × 10 -18, H2S 饱和溶液中 c (H+)与 c (S2-)之间存在如下关系: c2 (H+) ·c(S2-) = 1.0×10-22。在该温度下,将适量 FeS 投入硫化氢饱和溶液中,欲使溶液中(Fe2+)为 lmol/L,应调节溶液的c(H十)为__________________。
(6)某人设想以右图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式______.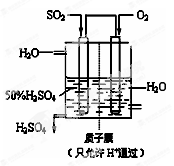
(12分)已知A为蓝色溶液,B、C、I、K为单质,其余均为化合物,其中B、L、I、K 常温下为气体,且I为有色气体。G为黑色固体,F的焰色反应透过蓝色钻玻璃片显紫色,各物质转化关系如图。
回答下列问题:
(1)P的电子式是_________________;
(2)C元素原子价电子排布式为: 。
(3)已知B、H和C2H5OH能够组成燃料电池,写出该燃料电池的负极反应式:
_______________________________________________________________;
(4)A的水溶液呈___________(填“酸性”“碱性”“中性”),用离子方程式和必要的文字说明原因______________________________________________________________
(5)用惰性电极电解400.00 mL A溶液,一段时间内测得溶液pH=1,则需要向溶液中加入___________,其质量为______g,才能使溶液恢复到电解前的状态(不考虑溶液体积变化)。