下列有关电化学原理的说法中,错误的是
| A.在现实生活中,电化学腐蚀要比化学腐蚀严重的多,危害更大 |
| B.在铜的精炼装置中,通常用粗铜作作阳极,精铜作阴极 |
| C.氯碱工业,主要依托电解熔融的氯化钠来制取工业上重要的化工原料烧碱和氯气 |
| D.可充电的电池称“二次电池”,在充电时,是将电能转变成化学能,在放电时,又将化学能转化成电能 |
500mLKNO3和Cu(NO3)2的混合溶液中c(NO3-)为6.0 mol•L-1,用石墨电极电解此溶液,当通电一段时间后,两极均收到22.4L气体(标准状况),假定电解后溶液体积仍为500mL,下列说法正确的是
| A.原混合溶液中c(K+)为4mol/L |
| B.原溶液中c(Cu2+)为1mol/L |
| C.电解后溶液中c(H+)为8mol/L |
| D.电解后加入1molCu(OH)2可使溶液复原 |
工业上常用电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法正确的是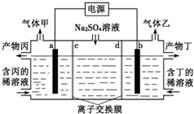
| A.a极与电源的负极相连 |
| B.产物丙为硫酸溶液 |
| C.离子交换膜d为阴离子交换膜 |
| D.a电极反应式:2H2O+2e-=H2↑+2OH- |
Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液(加入一定量酸),示意图如下。该电池工作时,下列说法正确的是
| A.Mg电极是该电池的正极 |
| B.电池总反应为Mg+H2O2+2H+=Mg2++ 2H2O |
| C.电池工作时,石墨周围海水的pH减少 |
| D.电池工作时,溶液中的H+向负极移动 |
将两个铂电极放置在KOH溶液中,然后分别向两极通入CH4和O2,即可产生电流。下列叙述正确的是
①通入CH4的电极为正极;
②正极的电极反应式为:O2+2H2O+4e-=4OH-;
③通入CH4的电极反应式为:CH4+2O2+4e-=CO2+2H2O;
④负极的电极反应式为:CH4+10OH--8e-=CO32-+7H2O;
⑤放电时溶液中的阳离子向负极移动;
⑥放电时溶液中的阴离子向负极移动.
| A.①③⑤ | B.②④⑥ | C.④⑤⑥ | D.①②③ |
C-NaMO2电池是科学家正在研发的钠离子电池,据悉该电池可以将传统锂电池的续航能力提升7倍。该电池的电池反应式为:NaMO2 + nC Na(1-x)MO2 + NaxCn,下列有关该电池的说法正确的是
Na(1-x)MO2 + NaxCn,下列有关该电池的说法正确的是
| A.电池放电时,溶液中钠离子向负极移动 |
B.该电池负极的电极反应为NaMO2-xe- Na(1-x)MO2+xNa+ Na(1-x)MO2+xNa+ |
| C.消耗相同质量金属时,用锂作负极产生电子的物质的量比用钠时少 |
D.电池充电时的阳极反应式为:nC+xNa+-xe- NaxCn NaxCn |
下图是一个化学过程的示意图。

(1)图中甲池中OH-移向 极(填“CH3OH”或“O2”)。
(2)写出通入CH3OH的电极的电极反应式: 。
(3)向乙池两电极附近滴加适量紫色石蕊试液,附近变红的电极为 极(填“A”或"B”),并写出此电极的反应式:____ 。
(4)乙池中总反应的离子方程式:____ 。
(5)当乙池中B(Ag)极的质量增加5.4g时,乙池的pH是 (若此时乙池中溶液的体积为500mL);此时丙池某电极析出1.60g某金属,则丙中的某盐溶液可能是 (填序号)。
| A.MgSO4 | B.CuSO4 | C.AgNO3 | D.AlCl3 |
列关于化学电源的叙述错误的是
| A.铅蓄电池中覆盖着PbO2的电极板是负极板 |
| B.普通锌锰干电池中碳棒为正极 |
| C.氢氧燃料电池的正极是通入氧气的那一极 |
| D.碱性锌锰干电池的比能量和储存时间比普通锌锰干电池高 |
下图所示的四个容器中分别盛有不同的溶液,除a、b外,其余电极均为石墨电极。甲为铅蓄电池,其工作原理为:Pb+PbO2+2H2SO4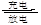 2PbSO4+2H2O,其两个电极的电极材料分别为PbO2和Pb。闭合K,发现g电极附近的溶液先变红,20min后,将K断开,此时c、d两极上产生的气体体积相同;据此回答:
2PbSO4+2H2O,其两个电极的电极材料分别为PbO2和Pb。闭合K,发现g电极附近的溶液先变红,20min后,将K断开,此时c、d两极上产生的气体体积相同;据此回答:
(1)a电极的电极材料是 (填“PbO2”或“Pb”)。
(2)丙装置中发生电解的总反应方程式为 。
(3)电解20min时,停止电解,此时要使乙中溶液恢复到原来的状态,需要加入的物质及其物质的量
是 。
(4)20min后将乙装置与其他装置断开,然后在c、d两极间连接上灵敏电流计,发现电流计指针偏转,则此时c电极为 极,d电极上发生反应的电极反应式为 。
(5)电解后取a mL丁装置中的溶液,向其中逐滴加入等物质的量浓度的CH3COOH溶液,当加入b mL CH3COOH溶液时,混合溶液的pH恰好等于7(体积变化忽略不计)。已知CH3COOH的电离平衡常数为1.75×10-5,则a/b = 。
液体燃料电池相比于气体燃料电池具有体积小等优点。一种以液态肼(N2H4)为燃料的电池装置如下图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。下列关于该电池的叙述正确的是
| A.b极发生氧化反应 |
| B.a极的反应式:N2H4+4OH--4e-===N2↑+4H2O |
| C.放电时,电流从a极经过负载流向b极 |
| D.其中的离子交换膜需选用阳离子交换膜 |
以酸性氢氧燃料电池为电源进行电解的实验装置如下图。下列叙述正确的是( )
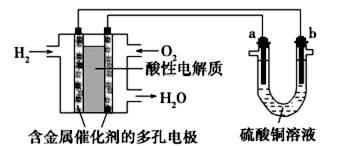
| A.燃料电池工作时,正极反应为O2+2H2O+4e-=4OH- |
| B.a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出 |
| C.a、b两极若是石墨,在相同条件下a极产生的气体与电池中消耗的H2体积相等 |
| D.a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出 |
银锌电池广泛用做各种电子仪器的电源,它的电池反应是:Zn+Ag2O+H2O=2Ag+Zn(OH)2,则负极上发生反应的物质是
| A.Ag | B.Zn(OH)2 | C.Ag2O | D.Zn |
镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按右式进行:Cd+2NiOOH+2H2O Cd(OH)2+2Ni(OH)2由此可知,该电池充电时在阴极上发生反应的是
Cd(OH)2+2Ni(OH)2由此可知,该电池充电时在阴极上发生反应的是
| A.Ni(OH)2 | B.Cd(OH)2 | C.Cd | D.NiOOH |
请按要求写出下列反应方程式:
(1)请写出下列溶液水解(或双水解)的离子反应方程式:
①次氯酸钠溶液:
②泡沫灭火器工作原理:
③氯化铁溶液与偏铝酸钾溶液混合:
(2)请写出酸性条件下氢氧燃料电池的电极反应方程式:
负极:
正极: