环戊二烯(  )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
(1)已知: 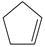 (g) =
(g) = 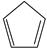 (g)+H 2(g) Δ H 1=100.3kJ·mol −1 ①
(g)+H 2(g) Δ H 1=100.3kJ·mol −1 ①
H 2(g)+ I 2(g) =2HI(g) Δ H 2=−11.0 kJ·mol −1 ②
对于反应:  (g)+ I 2(g) =
(g)+ I 2(g) = 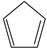 (g)+2HI(g) ③ Δ H 3=________kJ·mol −1。
(g)+2HI(g) ③ Δ H 3=________kJ·mol −1。
(2)某温度下,等物质的量的碘和环戊烯( 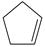 )在刚性容器内发生反应③,起始总压为10 5Pa,平衡时总压增加了20%,环戊烯的转化率为________,该反应的平衡常数 K p=________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有________(填标号)。
)在刚性容器内发生反应③,起始总压为10 5Pa,平衡时总压增加了20%,环戊烯的转化率为________,该反应的平衡常数 K p=________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有________(填标号)。
| A. |
通入惰性气体 |
B. |
提高温度 |
| C. |
增加环戊烯浓度 |
D. |
增加碘浓度 |
(3)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是__________(填标号)。
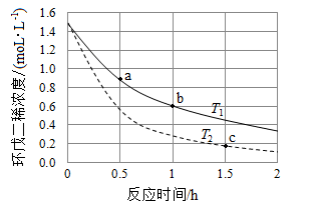
| A. |
T 1> T 2 |
| B. |
a点的反应速率小于c点的反应速率 |
| C. |
a点的正反应速率大于b点的逆反应速率 |
| D. |
b点时二聚体的浓度为0.45 mol·L −1 |
(4)环戊二烯可用于制备二茂铁(Fe(C 5H 5) 2结构简式为  ),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。
),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。
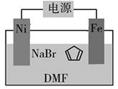

该电解池的阳极为________,总反应为________。电解制备需要在无水条件下进行,原因为________。
是一种重要的无机化合物,可作为食盐中的补碘剂。回答下列问题:
(1) 的化学名称是________。
(2)利用" 氧化法"制备 工艺流程如下图所示:

"酸化反应"所得产物有 、 和 。"逐 "采用的方法是________。"滤液"中的溶质主要是________。"调pH"中发生反应的化学方程式为________。
(3) 也可采用"电解法"制备,装置如图所示。
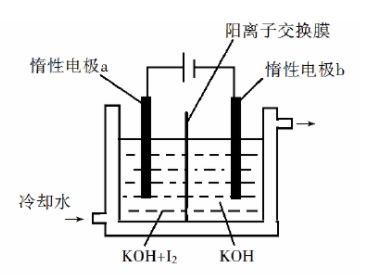
①写出电解时阴极的电极反应式________。
②电解过程中通过阳离子交换膜的离子主要为________,其迁移方向是________。
③与"电解法"相比," 氧化法"的主要不足之处有________(写出一点)。
我国是世界上最早制得和使用金属锌的国家。一种以闪锌矿(ZnS,含有  和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:
和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:

相关金属离子  形成氢氧化物沉淀的pH范围如下:
形成氢氧化物沉淀的pH范围如下:

回答下列问题:
(1)焙烧过程中主要反应的化学方程式为________。
(2)滤渣1的主要成分出 外还有________;氧化除杂工序中ZnO的作用是________.若不通入氧气,其后果是________。
(3)溶液中的 可用锌粉除去,还原除杂工序中反应的离子方程式为________。
(4)电解硫酸锌溶液制备单质锌时,阴极的电极反应式为________;沉积锌后的电解液可返回________工序继续使用。
为验证不同化合价铁的氧化还原能力,利用下列电池装置进行实验。
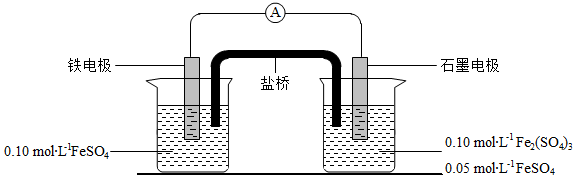
回答下列问题:
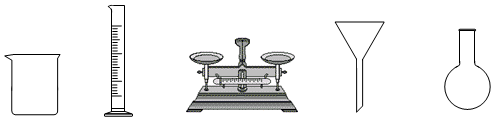
(1)由FeSO 4•7H 2O固体配制0.10mol•L ﹣ 1FeSO 4溶液,需要的仪器有药匙、玻璃棒、 (从下列图中选择,写出名称)。
(2)电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u ∞)应尽可能地相近。根据下表数据,盐桥中应选择 作为电解质。
| 阳离子 |
u ∞×10 8/(m 2•s ﹣ 1•V ﹣ 1) |
阴离子 |
u ∞×10 8/(m 2•s ﹣ 1•V ﹣ 1) |
| Li + |
4.07 |
HCO 3 ﹣ |
4.61 |
| Na + |
5.19 |
NO 3 ﹣ |
7.40 |
| Ca 2+ |
6.59 |
Cl ﹣ |
7.91 |
| K + |
7.62 |
SO 4 2 ﹣ |
8.27 |
(3)电流表显示电子由铁电极流向石墨电极。可知,盐桥中的阳离子进入 电极溶液中。
(4)电池反应一段时间后,测得铁电极溶液中c(Fe 2+)增加了0.02mol•L ﹣ 1.石墨电极上未见Fe析出。可知,石墨电极溶液中c(Fe 2+)= 。
(5)根据(3)、(4)实验结果,可知石墨电极的电极反应式为 ,铁电极反应式为 。因此,验证了Fe 2+氧化性小于 ,还原性小于 。
(6)实验前需要对铁电极表面活化。在FeSO 4溶液中加入几滴Fe 2(SO 4) 3溶液,将铁电极浸泡一段时间,铁电极表面被刻蚀活化。检验活化反应完成的方法是 。