某海域海水一些化学成分如下表
| 海水成分 |
Na+ |
Ca2+ |
Mg2+ |
HCO3- |
Zn2+ |
| 含量/mol·L-1 |
0.4 |
0.002 |
0.045 |
0.002 |
10-7 |
已知:25℃时,Ksp(CaCO3)=2.8×10-9、Ksp(MgCO3)=6.8×10-6,Ksp[Mg(OH)2]=1.8×10-11。
某化学小组同学欲在实验制备MgCl2,并提取Zn。设计流程如下:
[假设①②过程溶液体积不变,忽略分离过程的损失]
(1)25℃时测得海水的pH为8.0,其原因是(写离子方程式) 。
(2)下图为溶液pH与对应的Zn2+、[Zn(OH)4]2-物质的量浓度的对数坐标图。
请结合图中数据回答:
试剂X的化学式为 ;由滤液F到沉淀C过程(一般认为离子浓度低于10-5mol/L就是沉淀完全),则调节的pH的范围为 。
(3)同学们发现,把MgCl2溶液蒸发、灼烧所得的白色固体难溶解于水,于是认为其主要成分是MgO。你认为 (填“正确”、“不正确”),原因是(用化学方程式表示) 、 。
(4)由图中c(Zn2+)计算Zn(OH)2的溶度积Ksp= 。
已知A、B、C、D、E、F、G、H 可以发生如下图所示的转化,反应中部分生成物已略去。其中,A、G为同一主族元素的单质,B、C、H在通常情况下为气体,化合物C是一种形成酸雨的大气污染物。
请填空:
(1)反应①的化学方程式是 。
(2)反应④的离子方程式是 。
(3)写出反应③的化学方程式并标明电子转移方向及数目 。
(4)设计实验证明反应③的气体产物中既有B,又有C,可将气体依次通过:溶液Ⅰ、酸性高锰酸钾溶液、溶液Ⅰ、溶液Ⅱ,则溶液Ⅰ和溶液Ⅱ分别为(填试剂名称): 、 ,实验中两次使用溶液Ⅰ的作用分别是 , 。
(5)在工业生产上规定:空气中C的最大允许排放浓度不得超过0.02mg/L。
某同学拟用下列简易装置测定空气中C的含量:准确移取50mL 1×10-4mol/L的标准碘水溶液,注入下图所示广口瓶中,加2~3滴淀粉指示剂,此时溶液呈蓝色。在指定的测定地点抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止,记录抽气次数(n)。反应中碘发生的变化为I2→HI。
①写出C与碘水反应的化学方程式 ;
②若测得抽气次数为100,则空气中C的含量为 mg/L;
③乙同学抽气的次数至少为 次,方可说明该地空气中C的含量符合排放标准。
将镁、铝的混合物共0.2 mol,溶于200mL 4mol/L的盐酸溶液中,然后再滴加2 mol/L 的NaOH溶液。请回答下列问题:

(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化情况如图所示。当V1=160mL时,则金属粉末中n(Al)= mol;
(2)0~V1段发生的反应的离子方程式为 ;
(3)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积
V(NaOH)= mL。
(4)若镁、铝的混合物仍为0.2 mol,其中镁粉的物质的量分数为a,改用200 mL 4mol/L的硫酸溶解此混合物后,再加入840mL 2mol/L的NaOH溶液,所得沉淀中无Al(OH)3。则a的取值范围为 。
已知A、B均是由两种元素组成的化合物,A中某种元素的质量分数为75% ,B是一种淡黄色固体,C、J是同周期元素的气态氢化物,其中C是含氢量最高的烃,X为无色液体。反应生成的水均已略去。它们有如下图所示的关系。
(1)写出化学式:A B J 。
(2)反应③中每生成1molF,转移电子的数目为: 。
(3)反应④的化学方程式为: 。
(4)离子方程式分别为:反应② ;
⑤ 。
(5)反应①中,每1.00gC与足量的F作用,恢复到25oC放出55.6kJ热量,写出反应①的热化学方程式 。
(14分)A、B、C、D、E、F均为短周期元素,其原子序数依次增大。已知:A的最外层电子数等于其电子层数;B的最外层电子数是次外层电子数的两倍;D是地壳中含量最高的元素;D和F、A和E分别同主族;E是所有短周期主族元素中原子半径最大的元素。根据以上信息回答下列问题:
(1)B与D形成化合物BD2的结构式为 。
(2)A、C、D三元素能形成一种强酸甲,写出单质B与甲的浓溶液反应的化学反应方程式 。FD2气体通入BaCl2和甲的混合溶液,生成白色沉淀和无色气体CD,有关反应的离子方程式为_____。
(3)均由A、D、E、F四种元素组成的两种盐,其相对分子质量相差16,写出它们在溶液中相互作用的离子方程式为____________________________________;由B、D、E组成的盐溶于水后溶液显碱性,其原因是(用离子方程式表示)_______________。
(4)C2A4─空气燃料电池是一种碱性燃料电池。电解质溶液是20%~30%的KOH溶液。则燃料电池放电时:正极的电极反应式是______________;负极的电极反应式为 。
黄铜矿主要成分是二硫化亚铁铜(CuFeS2)。黄铜矿经熔炼、煅烧后得到粗铜和炉渣,冶炼过程的主要反应有:
(1)二硫化亚铁铜也可以表示为CuS·FeS,其中硫元素的化合价是 。
(2)反应②中还原剂是 。
(3)某校学习小组用炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3等)制备铁红,进行如下实验。
① 炉渣碱浸时反应的离子方程式是 、 。
② 滤渣1中加入硫酸并通入氧气可使FeO转化为Fe3+,该反应的离子方程式是 ;为检验铁元素是否被氧化完全,应进行的实验是:取少量滤液2于试管中 。
(1)已知下列反应在一定条件下可以发生:
H 2 O 2 +2Fe 2+ +2H + ="2Fe" 3+ +2H 2 O H 2 O 2 +2Fe 3+ ="2Fe" 2+ +O 2 ↑+2H +
(1)在以上反应中Fe 2+ 实际上起着_________作用,总反应式为______________。
(2)I 2 也与Fe 2+ 一样发生上述类似反应,类比(1)在下面填入配平的合适的化学反应方程式:
H2O2 +I2 =2HIO______________总反应式为_______________。
(3)在H 2 SO 4 和KI的混合溶液中加入足量的H2O2 ,放出大量的无色气体,溶液呈棕色,并可以使淀粉变蓝。有学生认为该反应的离子方程式为:H2O2 +2I-=I2 +O2↑+2H+ ,这个方程式正确吗?__________。若正确,理由是(若认为不正确,该步不必作答)___________。若不正确,原因是(若认为正确,该步不必作答)__________________,并写出正确的化学反应方程式为(若是离子反应,写出离子反应式,没有离子反应的,写出化学反应方程式):________________。
某大型精炼铜厂,在电解铜的阳极泥中含有3-14℅Se元素,(Se和S同主族化学性质相似)以Se单质、Cu2Se存在,还含有稀有金属及贵金属。人体缺乏Se就会得“克山病”,Se也是制光电池的一种原料。从阳极泥中提取Se的流程如下:
(1)流程②的目的是_________________.流程④操作用到的玻璃仪器有烧杯、______________。
H2SeO3与SO2的离子反应方程式为 。
(2)上述工业提取Se的流程中,SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是 。工业提取Se的流程中,可循环利用的物质是_________________。
(3)称取5.000g电解铜阳极泥样品以合适方法溶解,配成250.00mL混酸溶液,移取上述溶液25.00mL于锥形瓶中,加入25.00mL0.01000mol·L-1KMnO4标准溶液{只发生Se(+4)转化为Se(+6)}。反应完全后,用0.05000mol·L-1Fe2+标准溶液滴至终点,消耗15.00mL.则电解铜阳极泥中Se的质量分数为____________。若用FeCl2溶液为Fe2+标准溶液滴至终点,对测定Se的质量分数结果是否有影响,理由是_____________。
已知实验室制取Cl2的反应为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,又已知Pb的化合价只有+2、+4,且+4价的Pb具有强氧化性,也能氧化浓盐酸生成Cl2;
MnCl2+Cl2↑+2H2O,又已知Pb的化合价只有+2、+4,且+4价的Pb具有强氧化性,也能氧化浓盐酸生成Cl2;
(1)写出PbO2与浓盐酸反应的化学方程式 ,其中表现还原性的HCl与表现酸性的HCl的物质的量之比为
(2)已知硫酸铅不溶于水,铅蓄电池的工作原理为Pb+PbO2 +2H2SO4 =2PbSO4+2H20,写出该反应的离子方程式 ;溶液中硫酸根离子检验的方法为 。
(3)已知PbSO4不溶于水,但可溶于醋酸铵溶液,反应方程式如下:PbSO4 +2CH3COONH4=(CH3COO)2Pb+(NH4)2SO4.
①PbSO4与CH3COONH4能进行反应的原因是符合了复分解反应条件之一的生成了 ,现将Na2S 溶液与醋酸铅溶液混合有沉淀生成,则其反应的离子方程式应为 。
②已知+2价Sn的化合物具有强还原性。等物质的量的PbO2和SnO的混合物溶于过量的稀硫酸中,溶液中存在的主要金属阳离子是 (填序号)。
| A.Pb2+ | B.Pb4+ | C.Sn2+ | D.Sn4+ |
现有下列十种物质:①液态氯化氢②小苏打 ③固体纯碱 ④二氧化碳⑤葡萄糖 ⑥氢氧化钾 ⑦氢氧化铁胶体 ⑧氨水 ⑨空气 ⑩硫酸铁溶液
(1)上述十种物质中,属于电解质的有 ,属于非电解质的有 。
(2)有两种物质在水溶液中可发生反应,离子方程式为:H++OH-=H2O,该反应的化学方程式为 。
(3)除去③中少量②的操作是 ,化学方程式为 。
(4)标准状况下,___________L ④中含有0.4mol 氧原子。
(5)现有100 mL⑩溶液中含Fe3+ 5.6g,则溶液中SO42-的物质的量浓度是 。
(6)若在⑦中缓慢加入⑥,产生的现象是 。
(7)将①加入到⑧中,⑧的导电能力变化为__________(填“增强”、“减弱”或“基本不变”)。
(1)下列物质:①氯气、②铜片、③碳酸钙、④蔗糖、⑤HCl气体、⑥SO2气体、⑦氨水,能导电的是 ,属于电解质的是 。(填编号)
(2)现有:①铝、②二氧化硅、③二氧化硫、④二氧化碳、⑤三氧化二铁、⑥氢氧化钠、⑦氢氧化镁、⑧氢氧化铝、⑨氢氧化铁,能形成酸雨的是________;光纤制品的基本原料是__________;属于两性氢氧化物的是___________;红棕色固体是_____________。(填编号)
(3)节日焰火利用的是 反应,城市射灯在夜空形成五颜六色的光柱,属于 效应。
(4)胃舒平是治疗胃酸(盐酸)过多的常用药物。其中含有的有效成分是氢氧化铝,其治疗原理是(用化学方程式表示): ;碳酸氢钠也常用于治疗胃酸过多,写出反应的离子方程式 。
用含有Al2O3、SiO2和少量FeO·xFe2O3的铝灰制备Al2(SO4)3·18H2O,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ..再经过一系列操作,分离得到产品。
(1)步骤Ⅰ中过滤所得滤渣主要成分为:______________________,H2SO4溶解Al2O3的离子方程式为:______________________。
(2)步骤Ⅱ中加入KMnO4时发生反应的离子方程式为:_______________________。
(3)已知:生成氢氧化物沉淀的pH
| |
Al(OH)3 |
Fe(OH)2 |
Fe(OH)3 |
| 开始沉淀时 |
3.4 |
6.3 |
1.5 |
| 完全沉淀时 |
4.7 |
8.3 |
2.8 |
注:金属离子的起始浓度均为0.1 mol·L-1
①根据表中数据解释步骤Ⅱ的目的:__________________________,
②当Al3+开始沉淀时,Fe3+的浓度约为:_______________________。
(4)已知:一定条件下,MnO4-可与Mn2+反应生成MnO2。
①向Ⅲ的沉淀中加入浓盐酸并加热,能说明沉淀中存在MnO2的现象是: 。
②步骤Ⅳ中加入MnSO4的目的是: 。
(5)步骤Ⅴ中“一系列操作”是________________________、________________________。
某无色稀溶液X中,可能含有下表所列离子中的某几种。
| 阴离子 |
CO32-、SiO32-、AlO2-、Cl- |
| 阳离子 |
Al3+、Fe3+、Mg2+、NH4+、Na+ |
现取该溶液适量,向其中加入某试剂Y,产生沉淀物质的量(n)与加入试剂的体积(V)关系如图所示。
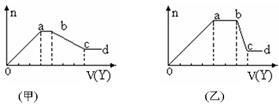
(1)若Y是盐酸,所得到的关系图如甲所示,则oa段转化为沉淀的离子(指来源于X溶液的,下同)是 ,ab段发生反应的离子 ,bc段发生反应的离子方程式 。
(2)若Y是NaOH溶液,所得到的关系图如乙所示,则X中一定含有的离子是 ,假设X溶液只含这几种离子,则溶液各离子物质的量之比为 ,ab段反应的离子方程式为 。
在生产生活中,卤族元素(F、Cl、Br、I)的单质及化合物用途广泛。
(1)溴元素在周期表中的位置为 。
(2)下列说法中正确的是 。
| A.CCl4和XeF2分子中各原子最外层均满足8e-结构 |
| B.Cl2O5和Cl2O7都是酸性氧化物 |
| C.氟非金属性强于氯,故氢氟酸的酸性强于盐酸 |
| D.F-、Cl-、Br-、I-等离子的还原性逐渐增强 |
(3)已知:HCl的沸点是﹣85.0℃,HF的沸点是19.5℃。HF的电子式为 ;从HF、HCl混合气体中分离出HF的方法是 。
(4)向NaClO浓溶液中加入Al2(SO4)3浓溶液,迅速生成大量白色沉淀,同时有无色气体产生。生成白色沉淀的离子方程式为 。无色气体的成分为 。
(5)潮湿的氯气与碳酸钠粉末反应可用于制取氯的最低价氧化物,反应还同时生成两种盐,该反应的化学方程式为 。
(6)已知:还原性HSO3¯>I¯,氧化性IO3¯> I2,在下图中画出向含3 mol NaHSO3的溶液中逐滴加入KIO3溶液的过程中,析出I2的物质的量与KIO3的物质的量之间关系的曲线。

某混合物,可能含有以下几种离子:K+、Cl-、NH4+、Mg2+、CO32-、Ba2+、SO42-,若将该混合物溶于水可得澄清溶液,现取3份各100 mL该溶液分别进行如下实验:
| 实验 序号 |
实验内容 |
实验结果 |
| 1 |
加AgNO3溶液 |
有白色沉淀生成 |
| 2 |
加足量NaOH溶液并加热 |
收集到气体1.12 L(已折算成标准状况下的体积) |
| 3 |
加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 |
第一次称量读数为6.63 g,第二次称量读数为4.66 g |
试回答下列问题:
(1)根据实验1对Cl-是否存在的判断是____________(填“一定存在”“一定不存在”或“不能确定”);根据实验1~3判断混合物中一定不存在的离子是____________。
(2)试确定溶液中一定存在的阴离子及其物质的量浓度((可以不填满,也可以增加)):
| 阴离子符号 |
物质的量浓度(mol/L) |
| |
|
| |
|
(3)试确定K+是否存在?________,如果存在物质的量浓度为__________,如果不存在理由是__ _。