元素周期表中第3周期元素的单质及其化合物的用途广泛。

(1)该周期元素中,半径最小的简单离子的结构示意图为 ,最活泼金属元素和最活泼非金属元素形成的化合物的电子式为 ;
(2)氯的氧化物具有强氧化性,其中ClO2可将弱酸性废水中的Mn 2+转化为MnO2而除去,同时ClO2被还原为Cl--,该反应的离子方程式为 ;
(3)已知SO2,NO分别与O2反应过程中能量变化如图所示:写出NO2和SO2在一定条件下发生反应的热化学方程式 。
有四种物质:①Al2O3、②HNO3、③NaHCO3、④Ba(OH)2。根据要求,回答下列问题:
(1)写出物质④的电离方程式_______________________________。
(2)写出物质②和③反应的离子方程式_______________________________。
(3)既能与强酸反应,又能与强碱反应的物质是____________(填序号)。
(1)中学常见的某有色物质,全部由短周期元素组成,能与水发生氧化还原反应,但反应中水既不作氧化剂也不作还原剂。试写出符合条件的两种物质(写化学式)________、________。
(2)在一定条件下,RO3n-和I-发生反应,离子方程式为: RO3n-+6I-+6H+=R-+3I2+3H2O , RO3n-中R元素的化合价为 ,R元素的原子最外层电子有 个。
利用I2的氧化性可测定钢铁中硫的含量。做法是将钢铁中的硫转化为H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为 ,该滴定反应的离子方程式为 。
写出下列反应的离子方程式。
①足量稀硝酸与CaCO3反应的离子方程式:
②稀硫酸和氢氧化钡溶液反应的离子方程式:
③等体积等物质的量浓度的碳酸氢钠溶液和氢氧化钡溶液反应的离子方程式:
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
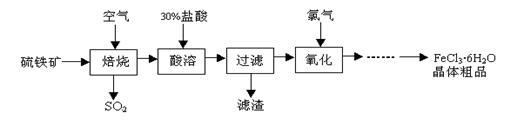
请回答下列问题:
(1)硫铁矿“焙烧”中反应的化学方程式为3FeS2 +8O2 + 6SO2,则 中的化学式为 ,反应中化合价升高的元素有 。
+ 6SO2,则 中的化学式为 ,反应中化合价升高的元素有 。
(2)“酸溶”中反应的化学方程式为 。
(3)“过滤”后滤液中金属阳离子有 。
(4)“氧化”中反应的离子方程式为 。
(5)该工艺流程中产生的SO2会污染空气,常用烧碱溶液来吸收。写出吸收过程中反应的化学方程式 。
无机化合物可根据其组成和性质进行分类,以下是一组对“一些物质与水反应”的分类图,请按要求填空:
(1)上述分类中,分成A、B两组的依据是____________________;
(2)C组物质与水反应的离子方程式为____________________;
(3)D组物质与水反应中,氧化剂和还原剂物质的量之比为1:1的物质有____________________;
(5分)向盛有1 mL 0.1 mol/L MgCl2溶液的试管中滴加1~2滴2 mol/L NaOH溶液,观察到有白色沉淀生成,该反应的离子方程式是________________。再滴加2滴0.1 mol/L FeCl3溶液,观察到白色沉淀转化为红褐色沉淀,该反应的离子方程式是___________________。由以上现象可以推知,相同条件下Mg(OH)2和Fe(OH)3中溶解度较大的是_________________。
无机化合物可根据其组成和性质进行分类:
(1)右图所示的物质分类方法名称是____________。
(2)以Na、K、H、O、C、S中任意两种或三种元素组成合适
的物质,分别填在下表②③⑥的后面。
| 物质类别 |
酸 |
碱 |
盐 |
氧化物 |
| 化学式 |
①HCl ②______ |
③______ ④Ba(OH)2 |
⑤Na2CO3 ⑥______ |
⑦CO2 ⑧K2O |
(3)写出⑦转化为⑤的 离子方程式:______________________________。
(4)实验室制备⑦常用______和______反应(写物质的化学式),检验该气体的方法是____________。
工业上以废铜为原料经一系列化学反应可生产氯化亚铜(CuCl),其工艺流程如图所示:
试根据如图转化回答下列问题:
(1)工业生产Cl2时,尾气常用石灰乳吸收,而不用烧碱溶液吸收的原因是__________。
(2)还原过程中的产物为Na[CuCl2],试写出反应的化学方程式__________,制备中当氯化完成后必须经还原过程再制得CuCl,为什么不用一步法制得CuCl?(已知Cu2++Cu+2Cl-═2CuCl↓) __________。
(3)还原过程中加入少量盐酸的作用是__________,加入NaCl且过量的原因是__________。
(4)合成结束后所得产品用酒精淋洗的目的是__________。
(5)实验室中在CuCl2热溶液中通入SO2气体也可制备白色的CuCl沉淀,试写出该反应的离子方程式__________。
烟气中主要污染物为SO2、NO、NO2,可用如下工艺进行脱硫脱硝及产物回收。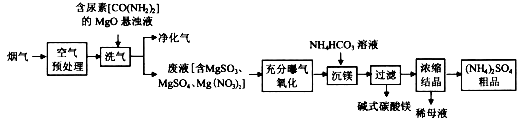
(1)空气预处理过程中,发生主要反应的化学方程式为____________________________。
(2)洗气过程中,尿素作还原剂,转化成两种无污染的气体是_________________(填化学式)。
(3)充分曝气氧化过程中,发生反应的化学方程式为___________________。
(4)完成沉镁过程中生成碱式碳酸镁[MgCO3∙Mg(OH)2]的离子方程式
______Mg2++______= MgCO3∙Mg(OH)2↓+______CO2↑+______H2O
(5)(NH4)2SO4粗品中含有的主要杂质为__________(填名称)。
(6)碱式碳酸镁经过简单加工可循环利用,加工过程发生反应的化学方程式为________________。
①HCl、②过氧化钠、③碳酸氢钠、④二氧化硅是常见的物质。请回答下列问题。
(1)上述4种物质中属于盐的是 (填序号,下同);上述四种物质加入紫色石蕊溶液中,溶液变红的是 。
(2)写出HCl的电离方程式 。
(3)写出过氧化钠与水反应的化学方程式___________________________。
(4)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为______________。
(5)写出二氧化硅与氢氧化钠溶液反应的化学方程式_______________________。
在人类社会的发展进程中,金属起着重要的作用。
(1)以下有关金属单质的叙述正确的是。
A.金属钠非常活泼,在实验室中保存在石蜡油或煤油中
B.用坩埚钳夹住一小块铝箔,在酒精灯上加热,可观察到铝箔熔化,并有熔融物滴下
C.铁单质与水蒸气反应的化学方程式为:2Fe+3H2O(g) Fe2O3+3H2
Fe2O3+3H2
(2)把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐渐加入1.00mol/LHCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。

①A点的沉淀物的化学式为 。
②写出A点至B点发生反应的离子方程式: 。
③某溶液中溶有MgCl2和AlCl3两种溶质,若把两者分开,应选用的试剂为: 。
④原混合物中NaOH的质量是 g,C点(此时沉淀恰好完全溶解)HCl溶液的
体积为 mL。
对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。
(1)含氰废水中的CN-有剧毒。
①CN-中C元素显+2价, N元素显-3价,用原子结构解释N元素显负价的原因是
②在微生物的作用下,CN-能够被氧气氧化成HCO3-,同时生成NH3,该反应的离子方程式为 。
(2)含乙酸钠和对氯酚( )的废水可以利用微生物电池除去,其原理如下图所示。
)的废水可以利用微生物电池除去,其原理如下图所示。

①B是电池的 极(填“正”或“负”);
②A极的电极反应式为 。
(3)电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如下图所示(图中“HA”表示乳酸分子,A- 表示乳酸根离子)。

①阳极的电极反应式为
②简述浓缩室中得到浓乳酸的原理:
③电解过程中,采取一定措施可控制阳极室pH约为6-8,此时进入浓缩室的OH-可忽略不计。
400mL 10 g•L-1乳酸溶液通电一段时间后,浓度上升为145 g•L-1(溶液体积变化忽略不计),阴极上产生的H2在标准状况下的体积约为 L。(乳酸的摩尔质量为90 g• mol-1)
硫铁矿烧渣是一种重要的化工生产中间产物,主要成分是Fe3O4、Fe2O3、FeO和SiO2等。下面是以硫铁矿烧渣制备高效净水剂聚合硫酸铁的流程图:

(1)实验室实现“操作I”所用的玻璃仪器有玻璃棒、 和烧杯;
(2)硫铁矿烧渣在“酸溶”前要粉碎的主要目的是 ,检验“酸溶”后的溶液中含有Fe2+的试剂及现象是 ;
(3)“操作Ⅲ”系列操作名称依次为 、冷却结晶、过滤和洗涤。洗涤沉淀的方法是 ;
(4)加入适量H2O2的目的是氧化Fe2+,写出H2O2氧化Fe2+为Fe3+的离子方程式: 。