下列离子组中所给的离子在水溶液中能大量共存,且当加入试剂后反应的离子方程式书写完全正确的是( )
| 选项 |
离子组 |
加入试剂 |
发生反应的离子方程式 |
| A |
Fe3+、S2ˉ、Clˉ、Na+ |
NaOH溶液 |
Fe3++3OHˉ═Fe(OH)3↓ |
| B |
Na+、Al3+、Clˉ、SO42ˉ |
少量KOH溶液 |
Al3++3OHˉ═Al(OH)3↓ |
| C |
H+、Fe2+、SO42ˉ、NO3ˉ |
BaCl 2溶液 |
SO42ˉ+Ba2+═BaSO4↓ |
| D |
Na+、K+、ClOˉ、 SO42ˉ |
通入少量SO2 |
2ClOˉ+SO2+H2O═2HClO+SO32ˉ |
现有E、F、G、M、N五种可溶的强电解质,它们在水中电离产生下列离子(各种离子不重复)。
| 阳离子 |
H+、Na+、Al3+、Ag+、Ba2+ |
| 阴离子 |
OH-、Cl-、CO32-、NO3-、SO42- |
已知:①E、F两溶液呈碱性;G、M、N 溶液呈酸性。
②向N溶液中逐滴滴加F溶液至过量,沉淀量先增加后减少但不消失。
③M溶液与另外四种溶液反应都能产生沉淀。
下列说法正确的是( )
A.N溶液与过量的F溶液反应的离子方程式为: Ba2+ + SO42- = BaSO4↓
B.E溶液与N溶液混合发生反应的离子方程式为:2Al3+ + 3CO32- + 3H2O = 2Al(OH)3↓+ 3CO2↑
C.M溶液与F溶液混合产生的沉淀不能溶解于过量氨水中
D.将G溶液逐滴加入等体积、等物质的量的浓度的E溶液中,反应的离子方程式为
2H+ + CO32- = CO2↑+ H2O
能正确表示下列反应的离子方程式为
| A.硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S |
| B.NH4HCO3溶于过量的NaOH溶液中:HCO3−+OH−=CO32−+H2O |
| C.少量SO2通入苯酚钠溶液中:C6H5O−+SO2+H2O=C6H5OH+HSO3− |
| D.大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO−+CO2↑+H2O |
下列离子反应方程式正确的是
| A.在碳酸氢镁溶液中加入足量Ca(OH)2溶液: Mg2++HCO3-+Ca2++2OH–="=" MgCO3↓+CaCO3↓+2H2O |
| B.向饱和碳酸钠溶液通入过量的二氧化碳气体:CO32-+CO2+H2O=2HCO3- |
| C.将氯化亚铁溶液和稀硝酸混合:3Fe2++ 4H++NO3-= 3Fe3++2H2O+NO↑ |
| D.向明矾溶液中逐滴加入Ba(OH)2溶液至Al3+刚好沉淀完全: |
Al3+ +SO42—+Ba2+ +3OH—==BaSO4↓+Al(OH)3↓
下列离子方程式正确的是( )
| A.NaClO溶液中通入少量SO2:ClO-+SO2+H2O=2H++SO42-+Cl- |
| B.FeCl3溶液中通入过量H2S气体:2Fe3++3H2S=2FeS↓+S↓+6H+ |
| C.Na2CO3溶液中通入少量Cl2:2CO32-+Cl2+H2O=ClO-+Cl-+2HCO3- |
| D.NaHSO3溶液中通入少量Cl2:HSO3-+Cl2+H2O=3H++SO42-+2Cl- |
下列指定反应的离子方程式正确的是
| A.氯气溶于水:Cl2+H2O=2H++Cl-+ClO- |
| B.向CuSO4溶液中加入NaOH:Cu2++2OH-=Cu(OH)2↓ |
| C.在酸性溶液中,KIO3与KI反应生成I2:IO3-+I-+6H+=I2+3H2O |
| D.向Al2(SO4)3溶液中加入过量的NH3∙H2O:Al3++4NH3∙H2O=AlO2-+4NH4++2H2O |
下列离子方程式正确的是( )
| A.0.01mol/L NH4Al(SO4)2溶液与0.01mol/L Ba(OH)2溶液等体积混合 NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O |
| B.Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+=SO42-+3S↓+2H2O |
| C.将11.2L标准状况下的氯气通入200mL2mol/L的FeBr2溶液中,离子反应方程式为: 4Fe2++6Br-+5Cl2= 4Fe3++3Br2+10Cl- |
| D.铁粉中滴加少量浓硝酸:Fe+3NO3-+6H+= Fe3++3NO2↑+3H2O |
下列指定反应的离子方程式不正确的是
| A.硫代硫酸钠溶液与稀硫酸混合:S2O32-+2H+=S↓+SO2↑+H2O |
| B.向CuSO4溶液中通入H2S气体:Cu2++S2-=CuS↓↑ |
| C.向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色:2AgCl+S2-=Ag2S↓+2Cl- |
D.重铬酸钾的溶液中存在着如下平衡:Cr2O72-(橙红色)+H2O 2H++2CrO42-(黄色) 2H++2CrO42-(黄色) |
已知部分弱酸的电离平衡常数如下表:
下列离子方程式正确的是
A.少量CO2通入NaClO溶液中:CO2+H2O+2ClO-=CO +2HClO +2HClO |
| B.少量的SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO |
C.少量的SO2通入Na2CO3溶液中:SO2+H2O+2 CO =SO =SO +2HCO3- +2HCO3- |
| D.相同浓度NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-=CO2↑+H2O |
下列反应的离子方程式中正确的是
| A.向等物质的量浓度的NaOH和Na2CO3的混合液中加入一定量的稀盐酸:2OH-+CO32-+4H+=CO2↑+2H2O |
| B.Ca(HCO3)2溶液中滴加少量NaOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- |
| C.向Fe(OH)2中加入稀硝酸:3Fe2++4H++NO3-=3Fe3++ NO↑+ 2H2O |
| D.向AlCl3溶液中滴加过量氨水:Al3++3NH3·H2O = Al(OH)3↓+ 3NH4+ |
下列事实、离子方程式及其对应关系均正确的是
A.向Ag2S 浊液中滴加少量稀NaCl 溶液,黑色沉淀逐渐变成白色: Ag2S +Cl- AgCl +S2- AgCl +S2- |
| B.向K2Cr2O7 溶液中滴加少量浓H2SO4,溶液变为黄色: Cr2O72-(橙色) + H2O  2CrO42-(黄色) +2H+ 2CrO42-(黄色) +2H+ |
| C.向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时间后溶液变蓝: 4H+ + 4I- + O2= 2I2 + 2H2O |
D.向水杨酸(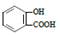 )中滴加NaHCO3溶液,放出无色气体: )中滴加NaHCO3溶液,放出无色气体: |
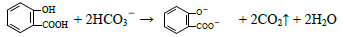
能正确表示下列反应的离子方程式是
| A.用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2=2NH4++SO32-+H2O |
| B.NaHSO3溶液中通入少量Cl2:HSO3- + Cl2+ H2O=3H+ +SO42- +2Cl- |
C.氯化钠与浓硫酸混合加热:H2SO4+2Cl- SO2↑+Cl2↑+H2O SO2↑+Cl2↑+H2O |
| D.磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-=3Fe3++NO↑+3H2O |
下列离子方程式正确的是( )
| A.0.01mol/L NH4Al(SO4)2溶液与0.02mol/L Ba(OH)2溶液等体积混合 NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O |
| B.FeCl2酸性溶液放在空气中变质:2Fe2++4H++O2===2Fe3++2H2O |
| C.用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ |
D.电解MgCl2水溶液的离子方程式:2Cl-+2H2O H2↑+Cl2↑+2OH- H2↑+Cl2↑+2OH- |
下列离子方程式书写正确的是
| A.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
| B.Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O |
C.以石墨作电极电解氯化铝溶液:2Cl-+2H2O 2OH-+H2↑+Cl2↑ 2OH-+H2↑+Cl2↑ |
| D.FeBr2与等物质的量的Cl2反应:2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2 |
下列离子方程式书写不正确的是( )
| A.AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=7:2时,2Al3+ + 7OH-=Al(OH)3↓+ AlO2- + 2H2O |
| B.CuCl2溶液与NaHS溶液反应,当n(CuCl2):n(NaHS)=1:2时Cu2++2HS-=CuS↓+H2S↑ |
| C.Cl2与FeBr2溶液反应,当n(Cl2):n(FeBr2)=1:1时,2Fe2+ + 4Br- +3Cl2=2 Fe3+ + 2Br2 + 6Cl- |
| D.Fe与稀硝酸反应,当n(Fe):n(HNO3)=1:2时,3 Fe +2NO3- +8H+=3Fe2+ +2NO↑+4H2O |